
【题目】下列除杂方法(括号内为杂质)正确的是( )
A.乙醇(水) 加新制的生石灰,过滤
B.乙烷(乙烯) 通过溴的四氯化碳溶液,洗气
C.溴苯(苯) 加水,振荡静置后分液
D.乙酸乙酯(乙酸) 加饱和Na2CO3溶液,振荡静置后分液
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】合理应用和处理元素化合物,在生产生活中有重要意义。
(1)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料。
①以尿素为原料在一定条件下发生反应:CO(NH2)2(s)+H2O(l)![]() 2NH3(g)+CO2(g) △H=+133.6 kJ·mol-1。该反应的化学平衡常数的表达式K=_________。
2NH3(g)+CO2(g) △H=+133.6 kJ·mol-1。该反应的化学平衡常数的表达式K=_________。
关于该反应的下列说法正确的是________(填序号)。
A.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
B.在平衡体系中增加水的用量可使该反应的平衡常数增大
C.当容器中NH3的体积分数不再改变时,反应处于平衡状态
②尿素在一定条件下可将氮的氧化物还原为氮气。

根据图像,结合①中信息,尿素还原NO(g)的热化学方程式是_________。
③密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:
CO2(g)+2NH3(g)![]() CO(NH2)2+H2O(g),混合气体中NH3 的物质的量百分含量[φ(NH3)]随时间变化关系如图所示。则a点的正反应速率V正(CO2)_____b点的逆反应速率V逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是_______。
CO(NH2)2+H2O(g),混合气体中NH3 的物质的量百分含量[φ(NH3)]随时间变化关系如图所示。则a点的正反应速率V正(CO2)_____b点的逆反应速率V逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是_______。
(2)在T℃下,分别在三个容积为10L的恒容绝热密闭容器中,发生反应: 2CO(g)+SO2(g) ![]() S(g)+2CO2(g) △>0, 测得相关数据如下表所示。
S(g)+2CO2(g) △>0, 测得相关数据如下表所示。

下列说法不正确的是________
A.反应开始时的速率:丙>乙 B. b=1.6 C.平衡常数:甲>乙
(3)ClO2是一种安全稳定的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备ClO2原理如下:

①a电极上产生的NCl3分子,常温下是一种黄色粘稠的油状液体,该分子的电子式为______。
②电解池中总反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究溶液导电性与离子浓度的关系,某课题小组设计了如下实验:
取一定质量Ba(OH)2溶液做导电性实验,往烧杯中滴加稀硫酸、装置如图1.测得溶液导电强度如图2所示。
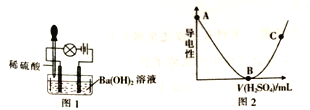
(1)根据组成分类、将盐分为正盐(如Na2CO3)、酸式盐(如NaHCO3)、碱式盐[如碱式碳酸铜Cu2(OH)2CO3等]。NaHSO4属于___________(填字母)。
A.钠盐 B.含氧酸 C.酸式盐 D.氧化物
(2)往烧杯中滴加稀硫酸的过程中,观察到灯泡变化:亮→暗→熄→亮,还可观察到的现象有_________。
(3)图2中,AB段变化的原因是__________;BC段变化的原因是_________。
(4)写出A→B过程中发生反应的离子方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁合金及镁的化合物在生产、生活中有着广泛的应用。
(1)镁在元素周期表中的位置是____________。
(2)用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁的关键流程如下:

① 一段脱水后,残留固体质量占原样品质量的64.5%,试确定生成物的化学式__________。② 二段脱水时,溶入H2和Cl2燃烧产物的目的是__________。
③ 该工艺中可循环使用的物质有_____________
(3)储氢材料Mg(AlH4)2在110-200℃的反应为:Mg(AlH4)2 =MgH2 +2Al+3H2↑,每转移6mol电子生成氢气的物质的量为__________mol。
(4)碱式碳酸镁密度小,是橡胶制品的优良填料,可用复盐MgCO3·(NH4)2CO3·2H2O作原料制备。
① 40℃时,复盐开始热解生成MgCO3·3H2O,并有气体产生,该反应的化学方程式为________。
② 制备过程中,需要用到卤水(氯化镁溶液)。某科研小组用沉淀滴定法分析产品中Cl-的含量,称取6.1000g产品用适量硝酸溶解,经稀释等步骤最终配得500mL 的溶液。
a.准确量取25.00mL 待测液,用0.1000 mol/ L AgNO3 标准液滴定,滴定前后滴定管中的液面读数如图所示,则滴定过程中消耗标准液的体积为______________mL。

b.
AgCl | AgBr | AgI | Ag2CrO4 | |
Ksp | 2×10-10 | 5.4×10-13 | 8.3×10-17 | 2×10-12 |
颜色 | 白 | 淡黄 | 黄 | 砖红 |
参照上表数据及信息分析,滴定时可以作指示剂的是________(填数字序号)。
① CaCl2 ② NaBr ③ NaI ④ K2CrO4
c.滴定时,应将溶液调成中性,不能是强酸性或强碱性,其中不能是强碱性的原因是________。
d.产品中氯的质量分数为___________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类或性质与应用均正确的是
A. SO2和Cl2都能使品红溶液褪色,两者等体积混合可以增强漂白能力
B. Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒
C. MgO、Al2O3的熔点很高,二者都可用于制作耐高温材料
D. Al(OH)3是一种强碱,可以与酸反应,可用作医用的胃酸中和剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲除去下列物质中混入的少量杂质(括号内物质为杂质),能达到目的的是
A. 乙酸乙酯(乙酸):加入饱和碳酸钠溶液,充分振荡静置后,分液
B. 苯(苯酚):加入浓溴水,过滤
C. 乙醇(水):加入金属钠,蒸馏
D. 乙烷(乙烯):通入酸性高锰酸钾溶液,洗气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)已知X、Y、Z、M、G、Q是六种短周期元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态;Y的原子最外层电子数是其电子层数的2倍;X与M同主族;Z、G分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号) 。
(2)Z在元素周期表中的位置为 。
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式) 。
(4)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式) ,在实验室中,制取该物质的反应原理是(写化学方程式) 。
(5)M2Z的电子式为 。MX与水反应可放出气体,该反应的化学方程式为 。
(6)常温下,不能与G的单质发生反应的是(填序号) 。
a.CuSO4溶液 b.Fe2O3c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
工业上用电解法制G的单质的化学方程式是 ,若以石墨为电极,阳极产生的混合气体的成分是(写化学式) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、生产密切相关。下列说法正确的是( )
A.蛟龙号潜艇中携带过氧化钠的目的是杀菌消毒,保障呼吸安全卫生
B.市售“锌强化酱油”中含有大量锌元素
C.向燃煤中加入CaO、推广油电混合汽车、电动汽车均符合绿色化学理念
D.金属冶炼、金属单质的生成都是吸热反应,金属腐蚀、金属单质的消耗都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中,第三、四、五、六周期元素的数目分别是
A. 8、8、18、32 B. 8、18、18、32 C. 8、18、18、18 D. 8、8、18、18
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com