
【题目】镁合金及镁的化合物在生产、生活中有着广泛的应用。
(1)镁在元素周期表中的位置是____________。
(2)用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁的关键流程如下:

① 一段脱水后,残留固体质量占原样品质量的64.5%,试确定生成物的化学式__________。② 二段脱水时,溶入H2和Cl2燃烧产物的目的是__________。
③ 该工艺中可循环使用的物质有_____________
(3)储氢材料Mg(AlH4)2在110-200℃的反应为:Mg(AlH4)2 =MgH2 +2Al+3H2↑,每转移6mol电子生成氢气的物质的量为__________mol。
(4)碱式碳酸镁密度小,是橡胶制品的优良填料,可用复盐MgCO3·(NH4)2CO3·2H2O作原料制备。
① 40℃时,复盐开始热解生成MgCO3·3H2O,并有气体产生,该反应的化学方程式为________。
② 制备过程中,需要用到卤水(氯化镁溶液)。某科研小组用沉淀滴定法分析产品中Cl-的含量,称取6.1000g产品用适量硝酸溶解,经稀释等步骤最终配得500mL 的溶液。
a.准确量取25.00mL 待测液,用0.1000 mol/ L AgNO3 标准液滴定,滴定前后滴定管中的液面读数如图所示,则滴定过程中消耗标准液的体积为______________mL。

b.
AgCl | AgBr | AgI | Ag2CrO4 | |
Ksp | 2×10-10 | 5.4×10-13 | 8.3×10-17 | 2×10-12 |
颜色 | 白 | 淡黄 | 黄 | 砖红 |
参照上表数据及信息分析,滴定时可以作指示剂的是________(填数字序号)。
① CaCl2 ② NaBr ③ NaI ④ K2CrO4
c.滴定时,应将溶液调成中性,不能是强酸性或强碱性,其中不能是强碱性的原因是________。
d.产品中氯的质量分数为___________(保留三位有效数字)。
【答案】 第三周期第ⅡA族 MgCl2·H2O 防止MgCl2·2H2O脱水过程中发生水解反应 HCl、Cl2 3 MgCO3·(NH4)2CO3·2H2O![]() MgCO3·3H2O+CO2↑+2NH3↑ 16.00 ④ 碱性条件下AgNO3会生成Ag2O 18.6%
MgCO3·3H2O+CO2↑+2NH3↑ 16.00 ④ 碱性条件下AgNO3会生成Ag2O 18.6%
【解析】 (1)镁为12号元素,在元素周期表中位于第三周期第ⅡA族,故答案为:第三周期第ⅡA族;
(2)①图中AB线段为“一段脱水”,设对应固体物质的化学式为MgCl2xH2O,根据![]() =0.645,计算得 x=2,所以B的化学式为MgCl22H2O,故答案为:MgCl22H2O;
=0.645,计算得 x=2,所以B的化学式为MgCl22H2O,故答案为:MgCl22H2O;
②二段脱水中通入HCl可以抑制MgCl2的水解,故答案为:为防止MgCl22H2O脱水过程中发生水解反应;
③根据制备金属镁工艺的关键流程分析,循环使用的物质是加入后在反应过程中又重新生成的物质,分析可知是氯气和氯化氢,故答案为:HCl,Cl2;
(3)储氢材料Mg(AlH4)2在110℃-200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,反应中生成3molH2转移电子6mol,所以每转移6mol电子生成3mol H2,故答案为:3;
(4)①根据元素守恒可知,复盐开始热解生成MgCO33H2O,并有气体产生,该气体应为二氧化碳和氨气,所以反应的化学方程式
为MgCO3·(NH4)2CO3·2H2O![]() MgCO3·3H2O+CO2↑+2NH3↑ ,故答案为:MgCO3·(NH4)2CO3·2H2O
MgCO3·3H2O+CO2↑+2NH3↑ ,故答案为:MgCO3·(NH4)2CO3·2H2O![]() MgCO3·3H2O+CO2↑+2NH3↑ ;
MgCO3·3H2O+CO2↑+2NH3↑ ;
② a.根据滴定前后滴定管中的液面读数可知硝酸银标准液的体积为18.5mL-2.5mL=16.00mL,故答案为:16.00;
b. 指示剂的作用是指示出氯离子恰好沉淀完全,即让氯离子先沉淀,沉淀完全后,再滴入硝酸银溶液会生成一种颜色不同的沉淀来指示沉淀终点,氯化银、溴化银、碘化银的组成都是1:1,依据Ksp可以直接比较溶解性大小为氯化银>溴化银>碘化银;随Ksp的减小,应先出现碘化银沉淀、再出现溴化银,最后才沉淀氯化银,所以①、②、③不符合滴定实验的目的和作用,铬酸银的阳、阴离子个数比为2:1,可以计算相同浓度的银离子沉淀氯离子、铬酸根离子需要的浓度,依据Ksp计算得到,Ksp(AgCl)= c(Ag+)c(Cl-)=2×10-10,Ksp(Ag2CrO4)= c(Ag+)2 c(CrO42-) =2.0×10-12,c(Cl-)=![]() ,c(CrO42-)=
,c(CrO42-)=![]() ;所以同浓度的银离子需要的氯离子浓度小于铬酸根离子浓度,说明铬酸银溶解度大于氯化银;加入K2CrO4,做指示剂可以正确的测定氯化物的含量,故④正确;故答案为:④;
;所以同浓度的银离子需要的氯离子浓度小于铬酸根离子浓度,说明铬酸银溶解度大于氯化银;加入K2CrO4,做指示剂可以正确的测定氯化物的含量,故④正确;故答案为:④;
c.碱性条件下,硝酸银会生成氢氧化银或氧化银沉淀,影响沉淀滴定,所以滴定时,溶液不能是强碱性,故答案为:碱性条件下,硝酸银会生成氢氧化银或氧化银沉淀;
d. 根据氯离子的物质的量与反应的硝酸银的物质的量相等可知,n(Cl-)=0.016L×0.1000 mol/ L=0.0016mol,产品中氯的质量分数=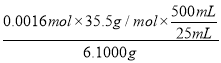 ×100%=18.6%,故答案为:18.6%。
×100%=18.6%,故答案为:18.6%。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 聚四氟乙烯的单体属于不饱和烃
B. 苯乙烯分子的所有原子不可能在同一平面上
C. 分子式为C4H10O属于醇的同分异构体有4种
D. 异丁烯及甲苯均能使溴水褪色,且褪色原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d 四瓶无色溶液,它们分别是Ba(OH)2溶液,NaHCO3溶液、MgCl2溶液、稀硫酸中的某一种。现各取少量溶液进行两两混合,实验现象如下表所示,表中“↓”表示生成沉淀;“↑”表示生成气体;“一”表示无明显现象。下列推理不正确的是

A. c一定是稀硫酸 B. d一定是MgCl2溶液
C. a可能是NaHCO3溶液 D. b一定是Ba(OH)2溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙是一种重要的化工原料,制备CaBr2·2H2O 的主要流程如下:
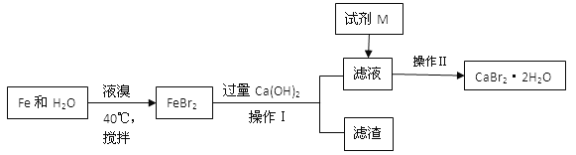
下列说法不正确的是
A. 试剂M 是HBr,加入HBr的目的是除去过量的Ca(OH)2
B. 操作I为过滤,滤渣为Fe、Fe(OH)2和Fe(OH)3;操作Ⅱ为重结晶,具体操作步骤为蒸发浓缩、冷却结晶、洗涤、干燥
C. 制得的CaBr2·2H2O 可以通过以下方法测定纯度:称取一定量的样品溶于水,滴入足量Na2CO3 溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却、称量,计算便得出CaBr2·2H2O的纯度
D. 工业上也可以将氨气通入石灰乳,并加入溴,于65℃进行反应,制得溴化钙,此反应中还会生成一种无色气体,该反应的化学方程式为3Ca(OH)2+3Br2+2NH3 ![]() 3CaBr2+N2+6H2O
3CaBr2+N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法错误的是
A. 氢氧化铁胶体可用于净水 B. Fe2O3可用作红色涂料
C. 纯碱溶液可用于去除油污 D. MnO2和浓HCl可用于工业制氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W是合成某药物的中间体,其结构简式如下:
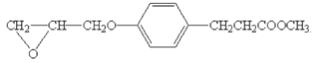
以有机物T为原料合成W的流程如图(部分条件省略):
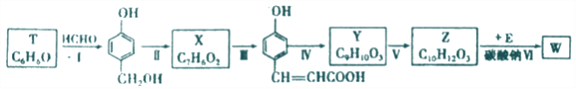
己知:RCH2ONa+CH3CH2X![]() RCH2OCH2CH3+NaX
RCH2OCH2CH3+NaX
请回答下列问题:
(1) Y中所含的官能团有_______.
(2)步骤Ⅵ中Na2CO3的作用为_______。
(3)请写出下列各步骤的反应类型:Ⅰ.__________;Ⅱ._________;Ⅴ.__________。
(4)利用步骤I的反应物,可制备某线型结构高分子,请写出相关化学反应方程式__________。
(5)物质X 最多可消耗H2______mol ,最终产物与足量HCOOH 完全反应的方程式为_______ 。
(6)写出同时满足下列条件的Y的所有同分异构体的结构简式:_______。
① 苯环上只有一个取代基
② 等量有机物分别与足量钠、足量碳酸氢钠溶液反应产生气体的物质的量相等
③ 在核磁共振氢谱图上有7个峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂方法(括号内为杂质)正确的是( )
A.乙醇(水) 加新制的生石灰,过滤
B.乙烷(乙烯) 通过溴的四氯化碳溶液,洗气
C.溴苯(苯) 加水,振荡静置后分液
D.乙酸乙酯(乙酸) 加饱和Na2CO3溶液,振荡静置后分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属及其化合物的说法正确的是( )
A. 俗语“真金不怕火炼”说明某些金属在高温的条件下也不与氧气发生反应
B. Na2O为淡黄色固体,MgO为白色固体
C. 铁不与冷、热水反应,高温下也不与水蒸气发生反应
D. 金属钠具有强还原性,可用与TiCl4溶液反应制取金属Ti
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硫、氮单质及其化合物的叙述正确的是
A. SO2、NO2均为酸性氧化物
B. “雷雨肥庄稼”与氮的固定有关
C. 硫粉在过量的纯氧中燃烧可以生成SO3
D. 铜片与稀盐酸不反应,向溶液中通入NO2后,铜片质量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com