
【题目】下列叙述正确的是( )
A.液态氯化氢、固体氯化钾均不导电,故HCl和KCl均为非电解质
B.NH3、SO3水溶液都能导电,故二者均为电解质
C.铜和石墨均能导电,所以它们都是电解质
D.蔗糖、乙醇在水溶液中和熔融状态下都不导电,所以它们是非电解质
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某碳酸钠样品中含有少量氯化钠杂质,为测定该样品中碳酸钠的质量分数,进行了如下实验:

请回答下列问题:
(1)操作A用到的玻璃仪器除烧杯外还必需有_______________、_______________;
(2)在实验过程中加入饱和石灰水后发生反应的离子方程式是_____________________。
(3)为探究上述反应后滤液中的溶质成分,甲同学向滤液中滴加过量稀盐酸,发现无气泡产生,说明滤液中一定不含 _________________(填溶质的化学式,下同),若有气泡产生,那么测定的样品中碳酸钠的质量分数___________(填偏大、偏小、无影响)。
(4)在(3)探究中,滴加盐酸前滤液中的溶质除氯化钠外,一定还含有的溶质是________;滴加盐酸的过程中一定发生反应的离子方程式为 ___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,碳素钢腐蚀与表面水膜pH的关系如下:
pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
腐蚀快慢 | 较快 | 慢 | 较快 | ||||
主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO |
下列说法不正确的是
A. 在pH<4的溶液中,主要发生析氢腐蚀
B. 在pH>6的溶液中,主要发生吸氧腐蚀
C. 在pH>14的溶液中,正极反应为O2+4OH-+4e-===2H2O
D. 在煮沸除氧气后的碱性溶液中,腐蚀速率会减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂。回答下列问题:
(1)NOCl虽然不稳定,但其原子均达到8e-稳定结构,NOCl的电子式为_________________。
(2)一定条件下,在密闭容器中发生反应:2NOCl(g)![]() 2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
序号 | c(NOCl)/(mol·L-1) | v正/(mol·L-1·s-1) |
① | 0.30 | 3.60×10-9 |
② | 0.60 | 1.44×10-8 |
则n=_________;k=___________。
(3)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
序号 | 热化学方程式 | 平衡常数 |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
则该温度下,ΔH3=______kJ/mol;K3=______(用K1和K2表示)。
(4)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图曲线a所示,则ΔH3=______(填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强(p)随时间(t)
的变化如图曲线b所示,则改变的条件是_____________;K3=___________L/mol;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________(填“增大”、“减小”或“不变”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是( )
A.强碱性溶液中:K+、Mg2+、Cl﹣、SO42﹣
B.滴加石蕊试液显红色的溶液::K+、Al3+、Cl﹣、NO3﹣
C.含有0.1molL﹣1Ca2+的溶液中:Na+、K+、CO32﹣、Cl﹣
D.无色透明的酸性溶液中:MnO4﹣、K+、SO42﹣、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用如图装置制取溴苯,并证明反应为取代反应。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
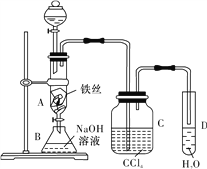
(1)观察到A中的现象是________________,D中导管口可观察到的现象是________________。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是__________________________。
(3)C中盛放CCl4的作用是________________。
(4)若要证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入________溶液,若观察到________________,即能证明。
(5)将锥形瓶中液体分液,得到的溴苯中仍含有杂质________及少量水分,用固体无水硫酸钠等作吸水剂可除去水分,另一种杂质的除去方法是________________(已知溴苯不溶于水,密度大于水,沸点156 ℃)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:

回答下列问题:
(1)写出所含物质的化学式:固体B_____,沉淀D_____。
(2)写出①、④两个反应的化学方程式:
①_______________________________________
④_______________________________________
(3)写出②、③两个反应的离子方程式:
②_______________________________________
③_____________________________________
(4)设计实验检验溶液F中所含溶质的阳离子:___________________________。
(5)分别写出Al2O3和Fe2O3在工业上的一种主要用途:
Al2O3︰_____________________________________
Fe2O3︰_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沉淀溶解平衡在生产、科研和环保等领域有着许多应用。
(1)除去硫酸铜溶液中混有的少量铁离子,可向溶液中加入Cu(OH)2,调节溶液的PH,铁离子就会全部转化为Fe(OH)3沉淀除去。
已知:常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小等于1×10-5molL-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0molL-1,通过计算确定应调节溶液的pH范围是______。(已知lg5=0.7)
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度AgSCN>AgI
操作步骤 | 现象 |
步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置 | 出现白色沉淀 |
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol·L-1 Fe(NO3)3溶液 | 溶液变为红色 |
步骤3:向步骤2的溶液中继续加入5滴3 mol·L-1 AgNO3溶液 | 现象a,溶液红色变浅 |
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液 | 出现黄色沉淀 |
①写出步骤2中溶液变为红色的离子方程式:____________________。
②步骤3中现象a是____________________________。
③用化学平衡原理解释步骤4中的实验现象:_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com