
【题目】下列物质的沸点的排列顺序正确的是
①丁烷 ②2-甲基丙烷 ③正戊烷 ④2-甲基丁烷 ⑤2,2-二甲基丙烷
A. ①>②>③>④>⑤ B. ⑤>④>③>②>①
C. ③>④>⑤>①>② D. ②>①>⑤>④>③
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )

A. 水合铜离子的模型如图甲所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图乙所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图丙所示,H原子核外大多数电子在原子核附近运动
D. 金属Cu中Cu原子堆积模型如图丁所示,为最密堆积,每个Cu原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活、社会及环境密切相关。下列有关说法正确的是
A. 我国南海海底存储的可燃冰的成分为多种烷烃的混合物
B. 硅酸钠的水溶液俗名是水玻璃,可用于制备硅胶和木材防火剂
C. 柴油、煤油、“地沟油”等主要成分都属于烃类
D. 利用明矾对疫区污水进行消毒处理是利用了明矾中铝离子的水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.乙醇既可以发生催化氧化反应,又可以发生酯化反应
B.用溴水可以鉴别乙醇、乙酸和苯
C.糖类、油脂、蛋白质三类物质都只含有C、H、O三种元素
D.C5H10O属于醛类的同分异构体为六种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知NO2和N2O4的结构式如右图所示。已知:N—N的键能为a kJ/mol,NO2和N2O4中N=O键键能分别是b kJ/mol和c kJ/mol。写出NO2转化为N2O4的热化学方程式________________(△H用a、b、c的代数式表示)。

(2)在100℃时,将0.4mol NO2放入2L的真空容器中发生反应:2NO2![]() N2O4。测得容器内气体的物质的量随时间变化如下表:
N2O4。测得容器内气体的物质的量随时间变化如下表:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.4 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
①上述条件下,前20s内以NO2表示的平均化学反应速率为_________________________;达到平衡状态时,NO2的转化率是________。
②n2_______ n3(填“>”、“=”、“<”)。
③80s时,向容器内加入NO2和N2O4各0.24mol,化学平衡将_________(填“向正反应方向移动”、“ 向逆反应方向移动”、“不移动”)。
④若将NO2的起始物质的量改为0.2mol,在相同条件下进行实验,要想达到与上述平衡相同的平衡状态,则起始时还需要加入适量的N2O4气体,则N2O4的浓度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用溴和苯反应制取溴苯,得到粗溴苯后,要用如下操作精制:①蒸馏;②水洗;③用干燥剂干燥;④用质量分数为10%的NaOH溶液洗。正确的操作顺序是()
A. ①②③①② B. ②④②③① C. ④②③①② D. ②④①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下:

已知:①A核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢;1 mol D可与1 mol NaOH或2 mol Na反应。
回答下列问题:
(1)A生成C的化学方程式为____________________________。
(2)C的官能团名称为____________。
(3)D的结构简式为_________________。
(4)由E生成F的反应类型为____________。
(5)L是D的同分异构体,可与FeCl3溶液发生显色反应,1 mol的L可与1 mol的Na2CO3反应,L核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1,L的结构简式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,里约奥运会游泳池因误多加H2O2导致水体变绿,发生反应H2O2+Cl2=2HCl+O2。下列说法不正确的是( )
A. 该反应是置换反应 B. Cl2发生还原反应
C. H2O2是氧化剂 D. 生成1molO2转移电子2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料和燃料。将CO2与含少量CO的H2混合,在恒容密闭容器中发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+ H2O(g),图1是在两种投料比[c(CO2)/c(H2+ CO)]分别为1:4和1:6时,CO2平衡转化率随温度变化的曲线, 图2是生成的甲醇/过氧化氢燃料电池的工作原理示意图
CH3OH(g)+ H2O(g),图1是在两种投料比[c(CO2)/c(H2+ CO)]分别为1:4和1:6时,CO2平衡转化率随温度变化的曲线, 图2是生成的甲醇/过氧化氢燃料电池的工作原理示意图
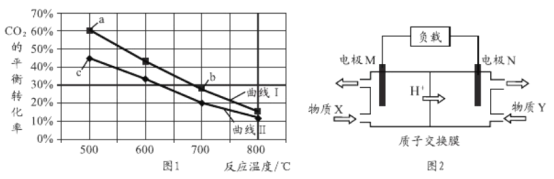
下列有关说法正确的是
A. 图1中b点对应的平衡常数K值大于c点
B. 图1中a点对应的H2的转化率等于30%
C. 图2中电极M上发生还原反应
D. 图2中电极N的反应式: H2O2 +2e- + 2H+= 2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com