
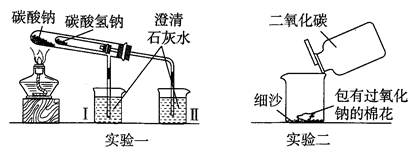
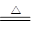 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑,故实验一的实验目的是比较Na2CO3和NaHCO3的热稳定性
Na2CO3+H2O+CO2↑,故实验一的实验目的是比较Na2CO3和NaHCO3的热稳定性

科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
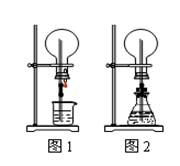
| A.Cu和稀盐酸 | B.NaHCO3与NaOH溶液 |
| C.MnO2与稀盐酸 | D.Na2CO3与稀盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 混合物 | 试剂 | 分离方法 |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| D | 溴苯(溴单质) | 苯 | 萃取 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
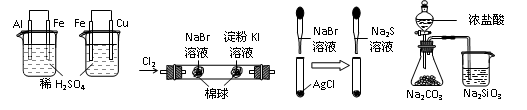
| 实 验 | 实验现象 | 结 论 |
| A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 白色固体先变为淡黄色,后变为黑色(Ag2S) | 溶解性 :AgCl>AgBr>Ag2S |
| D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 酸性:HCl>H2CO3>H2SiO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
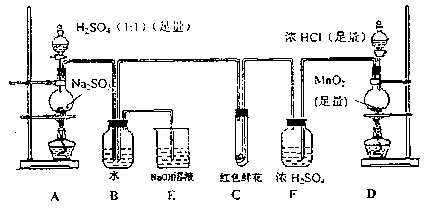
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只用一种试剂无法鉴别甲酸、乙醛和乙酸 |
| B.向淀粉和稀硫酸混合加热后的溶液中加入银氨溶液并水浴加热,可以检验淀粉水解后的产物 |
| C.将乙醇与浓硫酸在170℃共热制得的气体通入酸性KMnO4溶液中,可以检验生成的乙烯气体 |
| D.用饱和Na2CO3溶液收集乙酸和乙醇反应生成的乙酸乙酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com