
【题目】如图所示,甲、乙为相互串联的两电解池。
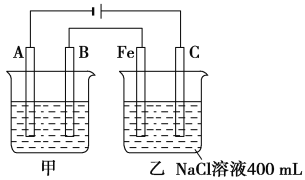
(1)甲池若为用电解原理精炼铜的装置,则A电极名称为________极,电极材料是________,电极反应式为_____________,电解质溶液可以是________。
(2)乙池中Fe极电极反应式为_________,若在乙池中滴入少量酚酞试液,开始通电一段时间,Fe极附近呈________色。
【答案】阴 精铜 Cu2++2e-=Cu 含Cu2+的溶液(如CuSO4溶液) 2H++2e-=H2↑ 红
【解析】
(1)依据电解精炼的原理是粗铜做阳极,精铜做阴极,含铜离子的电解质溶液进行电解反应,在阴极是溶液中铜离子得到电子生成铜;
(2)乙池中Fe极为阴极,阴极阳离子放电,根据反应判断Fe附近的酸碱性。
(1)电解精炼的原理是粗铜做阳极,精铜做阴极,含铜离子的电解质溶液(如CuSO4溶液)进行电解反应,在阴极是溶液中铜离子得到电子生成铜,电极反应是Cu2++2e═Cu;
故答案为:阴;纯铜; Cu2++2e-=Cu;含Cu2+的溶液(如CuSO4溶液);
(2)乙池C(石墨)极为电解池的阳极,Fe极为阴极,阴极阳离子放电,则Fe上氢离子得电子生成氢气,其电极反应为:2H++2e═H2↑,同时Fe电极附近还生成氢氧根离子,所以加酚酞溶液变红色;
故答案为:2H++2e═H2↑;红。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】羰基硫![]() 广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。有多种方法可以脱羰基硫中的硫,其中氢解和水解反应是两种常用的脱硫方法,
广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。有多种方法可以脱羰基硫中的硫,其中氢解和水解反应是两种常用的脱硫方法,
其反应式分别为:
①氢解反应:![]()
![]()
![]()
![]()
②水解反应:![]()
![]()
![]()
请回答下列问题:
(1)![]() 和
和![]() 能反应生成
能反应生成![]() 和
和![]() ,写出该反应的热化学方程式_______。
,写出该反应的热化学方程式_______。
(2)水解反应达到平衡后,若减小容器的体积,逆反应速率将______![]() 填增大、减少或不变,下同
填增大、减少或不变,下同![]() ,COS的转化率______。
,COS的转化率______。
(3)某温度下,体积为2L的恒容体系中,物质的量分别为m、n的COS蒸气和![]() 气发生氢解,已知COS的转化率为
气发生氢解,已知COS的转化率为![]() ,则该温度下的平衡常数表达式
,则该温度下的平衡常数表达式![]() ________________________
________________________![]() 用m、n、
用m、n、![]() 等符号表示
等符号表示![]() 。
。
(4)某科研小组研究改进催化剂![]() 和温度对COS水解的影响,得到如图
和温度对COS水解的影响,得到如图
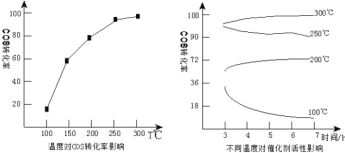
COS水解的最佳温度是__________________;理由是__________________________。
(5)研究表明,用金属储氢材料![]() 、白金
、白金![]() 、硫酸溶液组成的原电池可以发生羰基的氢解而脱硫处理。写出原电池的正极反应式____________________;
、硫酸溶液组成的原电池可以发生羰基的氢解而脱硫处理。写出原电池的正极反应式____________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AgCl的沉淀溶解平衡为AgCl(s)![]() Ag+(aq)+Cl(aq),下列说法中错误的是( )
Ag+(aq)+Cl(aq),下列说法中错误的是( )
A.向AgCl悬浊液中加少量水,c(Ag+)一定减小
B.AgCl饱和溶液中c(Ag+)=![]() mol/L
mol/L
C.用NaCl溶液代替蒸馏水洗涤AgCl沉淀,可以减少沉淀损失
D.反应AgCl+NaBr=AgBr+NaCl易进行,说明溶解度:AgCl>AgBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)=2HF(g),反应过程中的能量变化如图所示,下列说法正确的是( )
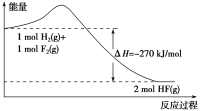
A.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量为270 kJ
B.氟化氢气体分解生成氢气和氟气的反应是放热反应
C.在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和大于2 mol HF(g)的能量
D.其他条件不变,加入催化剂,该反应的ΔH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,原因是(用离子方程式表示):___。
(2)调节pH,实验记录如下:
实验序号 | pH | 实验现象 |
a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液。
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应。
该学生对产生的白色沉淀提出了两种假设:
①白色沉淀为Ag2SO3。
②白色沉淀为Ag2SO4,推测的依据是___。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4。实验方法是:另取Ag2SO4固体置于__溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化。
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体。
Ⅲ.分别用Ba(NO3)2、BaCl2溶液检验Ⅱ中反应后的溶液,前者无明显变化,后者产生白色沉淀。
①实验Ⅰ的目的是___。
②根据实验现象分析,X的成分是___。
③Ⅱ中反应的化学方程式是___。
(5)该同学综合以上实验,分析产生X的原因:随着酸性的增强,体系的还原性增强。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们常将在同一原子轨道上运动的,自旋方向相反的2个电子,称为“电子对”;将在同一原子轨道上运动的单个电子,称为“未成对电子”![]() 以下有关主族元素原子的“未成对电子”的说法,错误的是
以下有关主族元素原子的“未成对电子”的说法,错误的是![]()
A.核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子”
B.核外电子数为偶数的基态原子,其原子轨道中一定不含“未成对电子”
C.原子轨道中含有“未成对电子”的基态原子,其核外电子数可能为偶数
D.原子轨道中不含“未成对电子”的基态原子,其核外电子数一定为偶数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:

(1)反应Ⅰ的化学方程式是______________________________________
(2)已知反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550 kJ·mol-1
它由两步反应组成:i.H2SO4(l)=SO3(g)+H2O(g) △H=+177 kJ·mol-1
ii.SO3(g)分解。
则SO3(g)分解的热化学方程式为____________________。
(3)L(L1、L2)、X可分别代表压强或温度其中之一。如图表示L一定时,ii中SO3(g)的质量分数随X的变化关系。

①X代表的物理量是__________。
②判断L1、L2的大小关系:L1_______L2,并简述理由:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能量的判断和表示方法正确的是( )
A.由C(s,石墨)=C(s,金刚石) ΔH=+1.9 kJ·mol-1,可知:金刚石比石墨更稳定
B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多
C.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol,可知:含1 mol/L CH3COOH的溶液与含1mol/L NaOH的溶液混合,放出热量等于57.3 kJ
D.2gH2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为H2(g)+![]() O2(g) =H2O(l) ΔH=-285.8 kJ/mol
O2(g) =H2O(l) ΔH=-285.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面的排序不正确的是( )
A.多电子原子轨道能量高低:4s>3p>3s>2px=2py
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:NaCl>SiO2>Hg>P4
D.晶格能由大到小:KF>KCl>KB>KI
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com