

| A. | I和Ⅲ | B. | I和IV | C. | Ⅱ和Ⅲ | D. | Ⅱ和IV |
分析 第一个装置是原电池,活泼金属锌为负极,溶液中的氧气在正极Ⅰ处得电子生成OH-,所以Ⅰ处变红;第二个装置是电解池,与电源正极相连的是电解池的阳极,所以锌为阳极,铁为阴极,溶液中的H+在阴极Ⅲ处得电子,破坏了铁片附近水的电离平衡,使得OH-浓度增大,所以Ⅲ处变红.
解答 解:第一个装置是原电池,活泼金属锌为负极,溶液中的氧气在正极Ⅰ处得电子生成OH-,O2+2H2O+4e-=4OH-,使得OH-浓度增大,所以Ⅰ处变红;
第二个装置是电解池,与电源正极相连的是电解池的阳极,所以锌为阳极,铁为阴极,溶液中的H+在阴极Ⅲ处得电子,2H++2e-=H2↑,破坏了铁片附近水的电离平衡,使得OH-浓度增大,所以Ⅲ处变红;
故选:A.
点评 本题考查了原电池和电解池的工作原理的应用,侧重考查学生分析和解决问题的能力,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氧元素的相对原子质量一定是$\frac{12a}{b}$ | |
| B. | 该氧原子的摩尔质量是aNAg | |
| C. | Wg该氧原子的物质的量是$\frac{W}{{(a•N}_{A})mol}$ | |
| D. | Wg该氧原子所含质子数是$\frac{16W}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
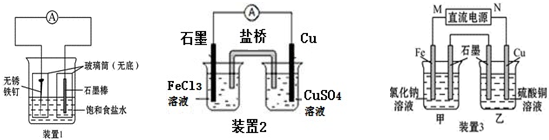
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
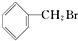 的说法中不正确的是( )
的说法中不正确的是( )| A. | 不能发生消去反应 | |
| B. | 所有的碳原子在同一个平面上 | |
| C. | 能够发生加成反应 | |
| D. | 水解生成的有机物可与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
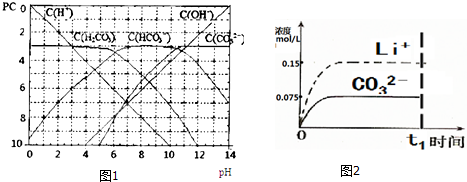
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
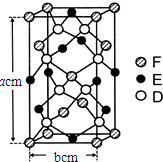 已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族. E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空:
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族. E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空: ,F原子的电子排布式是1s22s22p63s23p63d104s1.
,F原子的电子排布式是1s22s22p63s23p63d104s1. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com