
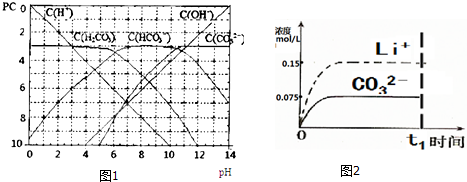
分析 (1)碳酸属于二元弱酸,在溶液中存在两步电离;
(2)根据图象分析;
(3)pH=6时溶液中c(H2CO3)=c(HCO3-),结合电离常数表达式计算;根据电离方程式书写;
(4)若t1时刻在上述体系中加入100mL0.125mol•L-1 Na2CO3溶液,c(Li+)=0.075mol/L,c(CO32-)=$\frac{0.1L×0.075mol/L+0.1L×0.125mol/L}{0.2L}$=0.1mol/L,计算Qc,与Li2CO3的Ksp比较,可确定是否有沉淀生成;
(5)t1时刻后,c(Li+)=0.075mol/l、c(CO32-)=0.01mol/l,据t1时刻后Li+和CO32-浓度画出图象.
解答 解:(1)碳酸属于二元弱酸,在溶液中存在两步电离,其电离方程式为:H2CO3?H++HCO3-,HCO3-?H++CO32-;
故答案为:H2CO3?H++HCO3-,HCO3-?H++CO32-;
(2)由图象可知,在pH=12时,溶液中浓度最大的含碳元素离子为CO32-;
故答案为:CO32-;
(3)pH=6时溶液中c(H2CO3)=c(HCO3-),Ka1=$\frac{c({H}^{+})×c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$=c(H+)=10-6;碳酸的第二步电离方程式为HCO3-?H++CO32-,则Ka2=$\frac{c({H}^{+})×c(C{{O}_{3}}^{2-})}{c({H}_{2}C{O}_{3})}$;
故答案为:10-6;$\frac{c({H}^{+})×c(C{{O}_{3}}^{2-})}{c({H}_{2}C{O}_{3})}$;
(4)(4)若t1时刻在上述体系中加入100mL0.125mol•L-1 Na2CO3溶液,c(Li+)=0.075mol/L,c(CO32-)=$\frac{0.1L×0.075mol/L+0.1L×0.125mol/L}{0.2L}$=0.1mol/L,
则Qc=c(CO32-)×c2(Li+)=5.6×10-5<1.68×10-3,则没有沉淀生成,
故答案为:c(Li+)=0.075mol/l、c(CO32-)=0.01mol/l,Qc=c(CO32-)•c2(Li+)=5.6×10-5<Ksp,无沉淀;
(5)t1时刻后,c(Li+)=0.075mol/l、c(CO32-)=0.01mol/l,据t1时刻后Li+和CO32-浓度画出图象为 ,
,
故答案为: .
.
点评 本题考查了弱电解质的电离方程式、图象分析、电离平衡常数的求算和表达式、沉淀的溶度积等,题目难度中等,侧重于考查学生对基础知识的应用能力和计算能力.


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2、CO2性质相似,都能在水溶液中被氯气氧化 | |
| B. | Na2O2、Na2O组成元素相同,与CO2反应产物也相同 | |
| C. | Mg和K在一定条件下与水反应都生成H2和对应的碱 | |
| D. | Na、Li同属于碱金属单质,在加热条件下与氧气反应都生成过氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只用溴水一种试剂就可鉴别乙烯、乙醇、四氯化碳四种物 | |
| B. | 将乙醇加热到170℃可制得乙烯 | |
| C. | 除去乙酸乙酯中的少量乙酸:加入NaOH溶液,振荡、静置后,分液 | |
| D. | 提取溶解在水中的少量碘:加入乙醇,振荡、静置分层后,取出有机层再分 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验;请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验;请完成下列填空:| 滴定次数 | 待测盐酸的体积(mL) | 标准NaOH溶液体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 20.00 | 0.40 | 20.50 |
| 第二次 | 20.00 | 4.10 | 24.00 |
| 第三次 | 20.00 | 1.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数是2 | B. | 电子数是2 | C. | 质量数是3 | D. | 中子数是1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素单质是导体 | |
| B. | 该元素单质在一定条件下能与盐酸反应 | |
| C. | 该元素的氧化物的水合物显碱性 | |
| D. | 该元素的最高价氧化物对应的水化物为两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ③⑤ | D. | ②⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com