
【题目】海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用.
(1)海水中盐的开发利用:Ⅰ.海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩.所建盐田分为贮水池、蒸发池和池.
II.目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用(写一点即可)
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示.请回答后面的问题:
Ⅰ.海水不能直接通入到该装置中,理由是 .
Ⅱ.B口排出的是(填“淡水”或“浓水”).
(3)用苦卤(含Na+、K+、Mg2+、Cl﹣、Br﹣等离子)可提取溴,其生产流程如下:
Ⅰ.若吸收塔中的溶液含BrO3﹣ , 则吸收塔中反应的离子方程式为 .
Ⅱ.通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液? .
Ⅲ.向蒸馏塔中通入水蒸气加热,控制温度在900C左右进行蒸馏的原因是 .
【答案】
(1)结晶;阻止H2与Cl2发生反应甚至发生爆炸或阻止Cl2与生成的NaOH溶液反应而使烧碱产品不纯等
(2)海水中含较多Mg2+和Ca2+等阳离子,电解时会产生Mg(OH)2、Ca(OH)2等沉淀从而堵塞阳离子交换膜;浓水
(3)3CO32﹣+3Br2=5Br﹣+BrO3﹣+3CO2↑;富集溴,提高Br2的浓度;温度过低难以将Br2蒸发出来,但温度过高又会将大量的水蒸馏出来
【解析】解:(1)Ⅰ、海水晒盐需要通过蒸发、结晶过程,所以还需要结晶池,所以答案是:结晶;Ⅱ、阳离子交换膜只能阳离子通过,阴离子和气体不能通过,用石墨作电解电解饱和氯化钠时,阳极上氯离子放电生成氯气,氯气不能通过阳离子交换膜而进入阴极,如果氯气进入阴极易和氢气混合产生爆炸,且易和氢氧化钠溶液反应生成氯化钠、次氯酸钠而导致制取的氢氧化钠不纯,所以答案是:阻止H2与Cl2发生反应甚至发生爆炸或阻止Cl2与生成的NaOH溶液反应而使烧碱产品不纯等;(2)Ⅰ、海水中含有海水中含较多Mg2+和Ca2+等阳离子,电解时阴极附近生成氢氧根离子,导致氢氧根离子和钙镁离子反应生成Mg(OH)2、Ca(OH)2等沉淀从而堵塞阳离子交换膜,从而抑制离子通过,导致电渗析法失败,所以答案是:海水中含较多Mg2+和Ca2+等阳离子,电解时会产生Mg(OH)2、Ca(OH)2等沉淀从而堵塞阳离子交换膜;②在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,①室离子浓度变小,②室离子浓度不大,离子浓度大的为浓水,所以浓水在B处排出,淡水在A处排出,所以答案是:浓水;(3)Ⅰ、纯碱是碳酸钠,与溴反应有BrO3﹣生成,反应的离子方程式为:3CO32﹣+3Br2=5Br﹣+BrO3﹣+3CO2↑,所以答案是:3CO32﹣+3Br2=5Br﹣+BrO3﹣+3CO2↑;Ⅱ、从①出来的溶液中溴的含量不高,如果直接蒸馏,产品成本高,所以需要进一步浓缩溴,提高溴的浓度,所以答案是:富集溴,提高Br2的浓度;Ⅲ、温度过高水蒸气蒸出,溴中含有水分,温度过低溴不能完全蒸出,产率低,所以答案是:温度过低难以将Br2蒸发出来,但温度过高又会将大量的水蒸馏出来.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定量的硫酸铜溶液,电解一段时间后,向电解液加入0.1mol碱式碳酸铜晶体(不含结晶水),恰好使溶液恢复到电解前的浓度和pH.下列有关叙述不正确的是( )
A.电解过程产生的气体体积(在标准状况下)为5.6 L
B.电解过程只发生了2CuSO4+2H2O ![]() 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
C.电解过程转移的电子数为3.612×1023个
D.加入的碱式碳酸铜的反应是:Cu2(OH)2CO3+2H2SO4═2CuSO4+CO2↑+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.
(1)写出溴乙烷在NaOH水溶液中的反应方程式:反应类型 . 某同学取少量溴乙烷与NaOH水溶液反应后的混合溶液,向其中滴加AgNO3 溶液,加热,产生少量沉淀.该同学由此得出溴乙烷与NaOH水溶液反应,生成了溴化钠,你认为是否合理,原因: .
(2)写出溴乙烷在NaOH乙醇溶液中的反应方程式反应类型 . 反应中生成的气体可以用上图所示装置检验,现象是 , 水的作用是 . 除高锰酸钾酸性溶液外,还可以用检验生成的气体,此时还有必要将气体先通入水中吗?(填“有”或“没有”)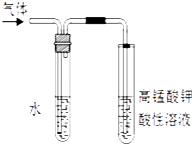
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A.向稀HNO3中滴加Na2SO3溶液SO ![]() +2H+═SO2↑+H2O
+2H+═SO2↑+H2O
B.CuSO4溶液与H2S反应的离子方程式:Cu2++S2﹣═CuS↓
C.氯气溶于水:Cl2+H2═2H++Cl﹣+ClO﹣
D.向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2═4Na++2Cu(OH)2↓+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁是海水中含量较多的金属元素,单质镁、镁合金以及镁的化合物在科学研究和工业生产中用途非常广泛.
(1)Mg2Ni是一种储氢合金,已知:
Mg(s)+H2(g)=MgH2(s)△H1=﹣74.5kJmol﹣1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s)△H2=﹣64.4kJmol﹣1
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s)△H3
则△H3=kJmol﹣1
(2)工业上可用电解熔融的无水氯化镁获得镁.其中氯化镁晶体脱水是关键的工艺之一.一种正在试验的氯化镁晶体脱水的方法是:先将MgCl26H2O转化为MgCl2NH4ClnNH3 , 然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为;
(3)镁的一种化合物氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等.为了确定实验室制备的Mg(ClO3)26H2O的纯度,做如下试验:
步骤1:准确称量3.50g产品配成100mL溶液.
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL 1.000molL﹣1的FeSO4溶液,微热.
步骤3:冷却至室温,用0.100molL﹣1 K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72﹣+6Fe2++14H+═2Cr3++6Fe3++7H2O.
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL.产品中Mg(ClO3)26H2O的纯度为(用百分号表示,精确到小数点后一位)
(4)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率如1图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是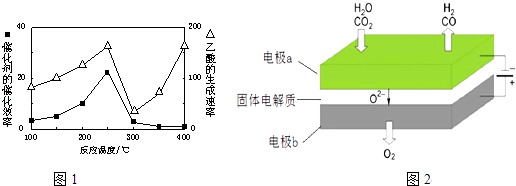
(5)Li2O、Na2O、MgO均能吸收CO2 .
①如果寻找吸收CO2的其它物质,下列建议合理的是
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4 , Li4SiO4用于吸收、释放CO2 , 原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2 , Li4SiO4再生,说明该原理的化学方程式是
(6)利用反应A可将释放的CO2转化为具有工业利用价值的产品.反应A:CO2+H2O ![]() CO+H2+O2高温电解技术能高效实现(3)中反应A,工作原理示意图如图2:CO2在电极a放电的反应式是 .
CO+H2+O2高温电解技术能高效实现(3)中反应A,工作原理示意图如图2:CO2在电极a放电的反应式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.12g铁粉加入25mL 2mol/L的FeCl3溶液中,充分反应后,其结果是( )
A.铁粉有剩余,溶液呈浅绿色,Cl﹣基本保持不变
B.往溶液中滴入无色KSCN溶液,不显红色
C.Fe2+和Fe3+物质的量之比为6:1
D.氧化产物和还原产物的物质的量之比为2:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一容积不变的密闭容器中,A(g)+2B(g)3C(g)达到平衡时,A.B和C的物质的量分别为3mol、2mol和4mol,若温度不变,向容器内的平衡混合物中再加入A、C各lmol,此时该平衡移动的方向为( )
A.向左移动
B.向右移动
C.不移动
D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去.常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质.反应①②均为工业上的重要反应.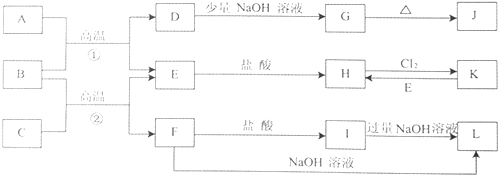
(1)反应②的化学方程式为 .
(2)G→J的化学方程式为 .
(3)K→H的离子方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com