
【题目】镁是海水中含量较多的金属元素,单质镁、镁合金以及镁的化合物在科学研究和工业生产中用途非常广泛.
(1)Mg2Ni是一种储氢合金,已知:
Mg(s)+H2(g)=MgH2(s)△H1=﹣74.5kJmol﹣1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s)△H2=﹣64.4kJmol﹣1
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s)△H3
则△H3=kJmol﹣1
(2)工业上可用电解熔融的无水氯化镁获得镁.其中氯化镁晶体脱水是关键的工艺之一.一种正在试验的氯化镁晶体脱水的方法是:先将MgCl26H2O转化为MgCl2NH4ClnNH3 , 然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为;
(3)镁的一种化合物氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等.为了确定实验室制备的Mg(ClO3)26H2O的纯度,做如下试验:
步骤1:准确称量3.50g产品配成100mL溶液.
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL 1.000molL﹣1的FeSO4溶液,微热.
步骤3:冷却至室温,用0.100molL﹣1 K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72﹣+6Fe2++14H+═2Cr3++6Fe3++7H2O.
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL.产品中Mg(ClO3)26H2O的纯度为(用百分号表示,精确到小数点后一位)
(4)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率如1图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是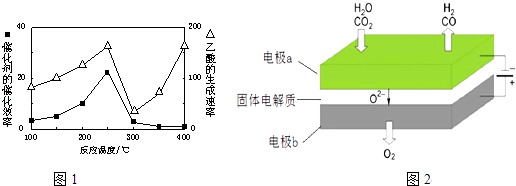
(5)Li2O、Na2O、MgO均能吸收CO2 .
①如果寻找吸收CO2的其它物质,下列建议合理的是
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4 , Li4SiO4用于吸收、释放CO2 , 原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2 , Li4SiO4再生,说明该原理的化学方程式是
(6)利用反应A可将释放的CO2转化为具有工业利用价值的产品.反应A:CO2+H2O ![]() CO+H2+O2高温电解技术能高效实现(3)中反应A,工作原理示意图如图2:CO2在电极a放电的反应式是 .
CO+H2+O2高温电解技术能高效实现(3)中反应A,工作原理示意图如图2:CO2在电极a放电的反应式是 .
【答案】
(1)+213.4
(2)MgCl2?NH4Cl?nNH3 ![]() MgCl2+(n+1)NH3↑+HCl↑
MgCl2+(n+1)NH3↑+HCl↑
(3)78.3%
(4)温度超过250℃时,催化剂的催化效率降低
(5)ab;CO2+Li4SiO4 ![]() Li2CO3+Li2SiO3
Li2CO3+Li2SiO3
(6)CO2+2e﹣═CO+O2﹣
【解析】解:(1)①Mg(s)+H2(g)═MgH2(s)△H1=﹣74.5kJmol﹣1
②Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=64.4kJmol﹣1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
由盖斯定律②﹣2×①得到Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3 =64.4KJ/mol﹣2×(﹣74.5KJ/mol)=213.4KJ/mol,则△H3=213.4KJ/mol,
所以答案是:213.4;(2)MgCl2NH4ClnNH3 , 在700℃脱氨得到无水氯化镁,反应的化学方程式MgCl2NH4ClnNH3 ![]() MgCl2+(n+1)NH3↑+HCl↑;所以答案是:MgCl2NH4ClnNH3
MgCl2+(n+1)NH3↑+HCl↑;所以答案是:MgCl2NH4ClnNH3 ![]() MgCl2+(n+1)NH3↑+HCl↑;(3)氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价,化学方程式为:ClO3﹣+6Fe2++6H+=6Fe3++Cl﹣+3H2O,根据化学方程式:ClO3﹣+6Fe2++6H+=6Fe3++Cl﹣+3H2O以及Cr2O72﹣+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3﹣~6Fe2+ , Cr2O72﹣~6Fe2+ , 用0.100molL﹣1 K2Cr2O7溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:0.100molL﹣1×0.015L×6=0.009mol,和氯酸根离子反应的亚铁离子的物质的量为:20×10﹣3L×1.000molL﹣1﹣0.009mol=0.011mol,
MgCl2+(n+1)NH3↑+HCl↑;(3)氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价,化学方程式为:ClO3﹣+6Fe2++6H+=6Fe3++Cl﹣+3H2O,根据化学方程式:ClO3﹣+6Fe2++6H+=6Fe3++Cl﹣+3H2O以及Cr2O72﹣+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3﹣~6Fe2+ , Cr2O72﹣~6Fe2+ , 用0.100molL﹣1 K2Cr2O7溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:0.100molL﹣1×0.015L×6=0.009mol,和氯酸根离子反应的亚铁离子的物质的量为:20×10﹣3L×1.000molL﹣1﹣0.009mol=0.011mol,
氯酸根离子的物质的量为: ![]() ×0.011mol,产品中Mg(ClO3)26H2O的质量分数:(
×0.011mol,产品中Mg(ClO3)26H2O的质量分数:( ![]() ×0.011×299g/mol)×10×
×0.011×299g/mol)×10× ![]() ×100%=78.3%,所以答案是:78.3%;(4)温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,故答案:温度超过250℃时,催化剂的催化效率降低;(5)①a.Li2O、Na2O、MgO均属于碱性氧化物,均能吸收酸性氧化物CO2 , 可在碱性氧化物中寻找吸收CO2的其他物质,故a正确;b.Li2O、Na2O、MgO均能吸收CO2 , 钠、镁、铝为ⅠA、ⅡA族元素,所以可在ⅠA、ⅡA族元素形成的氧化物中寻找吸收CO2的其他物质,故b正确;c.Li2O、Na2O、MgO均能吸收CO2 , 但它们都没有强氧化性,且吸收二氧化碳与氧化还原无关,故c错误;所以答案是:ab;②在500℃,CO2与Li4SiO4接触后生成Li2CO3 , 反应物为CO2与Li4SiO4 , 生成物有Li2CO3 , 根据质量守恒可知产物还有Li2SiO3 , 所以化学方程式为:CO2+Li4SiO4
×100%=78.3%,所以答案是:78.3%;(4)温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,故答案:温度超过250℃时,催化剂的催化效率降低;(5)①a.Li2O、Na2O、MgO均属于碱性氧化物,均能吸收酸性氧化物CO2 , 可在碱性氧化物中寻找吸收CO2的其他物质,故a正确;b.Li2O、Na2O、MgO均能吸收CO2 , 钠、镁、铝为ⅠA、ⅡA族元素,所以可在ⅠA、ⅡA族元素形成的氧化物中寻找吸收CO2的其他物质,故b正确;c.Li2O、Na2O、MgO均能吸收CO2 , 但它们都没有强氧化性,且吸收二氧化碳与氧化还原无关,故c错误;所以答案是:ab;②在500℃,CO2与Li4SiO4接触后生成Li2CO3 , 反应物为CO2与Li4SiO4 , 生成物有Li2CO3 , 根据质量守恒可知产物还有Li2SiO3 , 所以化学方程式为:CO2+Li4SiO4 ![]() Li2CO3+Li2SiO3 ,
Li2CO3+Li2SiO3 ,
所以答案是:CO2+Li4SiO4 ![]() Li2CO3+Li2SiO3;(6)二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为:CO2+2e﹣═CO+O2﹣ , 所以答案是:CO2+2e﹣═CO+O2﹣ .
Li2CO3+Li2SiO3;(6)二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为:CO2+2e﹣═CO+O2﹣ , 所以答案是:CO2+2e﹣═CO+O2﹣ .


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
【题目】观察如下反应,总结规律,然后完成下列问题:①Al(OH)3+H2OAl(OH) ![]() +H+;
+H+;
②NH3+H2ONH ![]() +OH﹣
+OH﹣
(A)已知B(OH)3是一元弱酸,试写出其电离方程式________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象.可以通过下列装置所示实验进行探究.下列说法正确的是( ) 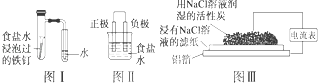
A.按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl﹣由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl﹣﹣2e﹣═Cl2↑
D.图Ⅲ装置的总反应为4Al+3O2+6H2O═4Al(OH)3 , 生成的Al(OH)3进一步脱水形成白斑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化: 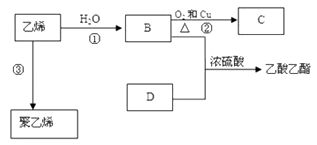
(1)乙烯的结构式为: .
(2)写出化合物官能团的化学式及名称:B中含官能团的化学式;官能团名称;
(3)写出反应的化学方程式②:反应类型:③:反应类型: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用.
(1)海水中盐的开发利用:Ⅰ.海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩.所建盐田分为贮水池、蒸发池和池.
II.目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用(写一点即可)
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示.请回答后面的问题:
Ⅰ.海水不能直接通入到该装置中,理由是 .
Ⅱ.B口排出的是(填“淡水”或“浓水”).
(3)用苦卤(含Na+、K+、Mg2+、Cl﹣、Br﹣等离子)可提取溴,其生产流程如下:
Ⅰ.若吸收塔中的溶液含BrO3﹣ , 则吸收塔中反应的离子方程式为 .
Ⅱ.通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液? .
Ⅲ.向蒸馏塔中通入水蒸气加热,控制温度在900C左右进行蒸馏的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4H2O).
CO(NH2)+2NaOH+NaClO═Na2CO3+N2H4H2O+NaCl
(1)实验一:制备NaClO溶液.(实验装置如图1所示)
①配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有(填标号).
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
②锥形瓶中发生反应的化学方程式是 .
③因后续实验需要,需利用中和滴定原理测定反应后锥形瓶中混合溶液的NaOH的浓度.请选用所提供的试剂,设计实验方案.提供的试剂:H2O2溶液、FeCl2溶液、0.1000molL﹣1盐酸、酚酞试液;
(2)实验二:制取水合肼.(实验装置如图2所示)
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应.加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分.(已知:N2H4H2O+2NaClO═N2↑+3H2O+2NaCl)分液漏斗中的溶液是(填标号).
A.CO(NH2)2溶液B.NaOH和NaClO混合溶液
选择的理由是 .
(3)实验三:测定馏分中肼含量.
称取馏分5.000g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL,用0.1000molL﹣1的I2溶液滴定.滴定过程中,溶液的pH保持在6.5左右.(已知:N2H4H2O+2I2═N2↑+4HI+H2O)
①滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是 .
②实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4H2O)的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列分析正确的是( ) 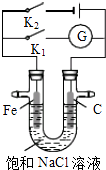
A.K1闭合,铁棒上发生的反应为2H++2e﹣→H2↑
B.K1闭合,石墨棒周围溶液pH逐渐降低
C.K2闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
D.K2闭合,电路中通过0.4NA个电子时,两极共产生4.48L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100molL﹣1 NaOH溶液分别滴定20.00mL 0.100molL﹣1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( ) 
A.Ⅱ表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗的V(NaOH)小于20mL
C.V(NaOH)=20.00mL时,两份溶液中c(Cl﹣)=c(CH3COO﹣)
D.V(NaOH)=10.00mL时,醋酸溶液中c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)地壳中含量第一金属元素构成的单质A与化合物B(分子量为232)发生置换反应,产物为黑色固体C和另一单质D,单质D与水蒸气在高温下可得到B.则
(i)写出构成金属单质A的元素在周期表中的位置为 .
(ii)写出D与水蒸气反应的化学方程式 .
(2)某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下: 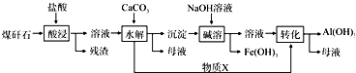
(i)物质X的化学式为 . “碱溶”时反应的离子方程式为 .
(ii)为加快“酸浸”时的速率,可采取的措施有、等.(填两种即可)
(iii)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4.为了获得更多产品Al(OH)3 , 从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作的实验方案是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com