
银铜合金广泛用于航空工业,从切割废料中回收银并制备铜化工产品的工艺如下: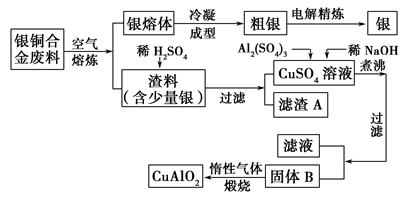
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450 ℃和80 ℃。)
(1)电解精炼银时,阴极反应式为________;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学反应方程式为________________。
(2)固体混合物B的组成为__________;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为____________。
(3)完成煅烧过程中一个反应的化学方程式:____CuO+____Al2O3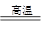 ____CuAlO2+________↑。
____CuAlO2+________↑。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0 kg废料中的铜可完全转化为________ mol CuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液________ L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是________、过滤、洗涤和干燥。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
我国濒临海域的省份,能够充分利用海水制得多种化工产品。下图是以海水、贝壳(主要成分CaCO3)等为原料制取几种化工产品的工艺流程图,其中E是一种化肥,N是一种常见的金属单质。
结合上述工艺流程回答下列问题:
(1)物质G和L的化学式分别为 和 ;固体B是生活中的一种必需品,主要用作
(2)上述工艺流程中可以循环使用的物质的化学式为
(3)反应①的化学方程式为 ;在反应①中必须先通入NH3,而后通入D,其原因是
(4)工业上利用F可制得另一种化工产品,该反应的化学方程式为
(5)由K溶液经如何处理才能制得N?
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应。
请回答下列问题:
(1)写出F的电子式:____________。
(2)①C溶液与D反应的离子方程式为________________________________________________________________________________________________________________________________________________;
②F溶液与NaOH溶液共热反应的化学方程式为________________________________________________________________________________________________________________________________________________。
(3)①请用离子方程式解释C溶液为何显酸性:________________________________________________________________________________________________________________________________________________,
②F溶液中离子浓度由大到小的顺序为________________________________________________________________________。
(4)将5.4 g A投入200 mL 2.0 mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是________(填代号)。
A.HNO3溶液 B.H2SO4溶液 C.NaOH溶液 D.HCl溶液
(5)将1 mol N2和3 mol G及催化剂充入容积为2 L的某密闭容器中进行反应,已知该反应为放热反应。平衡时,测得D的物质的量浓度为a mol/L。
①如果反应速率v(G)=1.2 mol/(L·min),则v(D)=________mol/(L·min)。
②在其他条件不变的情况下,若起始时充入0.5 mol N2和1.5 mol G达到平衡后,D的物质的量浓度________(填“大于”“小于”或“等于”) mol/L。
mol/L。
③该条件下的平衡常数为__________________(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知少量碳酸钠与足量盐酸反应,有二氧化碳气体放出;而少量盐酸与过量碳酸钠反应,则生成碳酸氢钠和氯化钠,无气体放出。现有A、B两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定两瓶溶液的成分及物质的量浓度,进行以下实验:
①取20mLA溶液,向其中缓慢滴入B溶液25mL,共收集到112mL(标准状况)气体。
②取25mLB溶液,向其中缓慢滴入A溶液20mL,共收集到56mL(标准状况)气体。
(1)写出少量盐酸与过量碳酸钠反应,无气体放出的离子方程式 ;
(2)为使上述①②反应完全,还需加入 ;(填“稀盐酸”或“碳酸钠溶液”)A溶液的物质的量浓度为 mol·L -1。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
烧结法制氧化铝生产过程如下: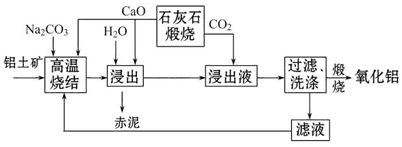
已知:
①铝土矿主要成分为:Al2O3、SiO2、Fe2O3和TiO2。
②高温烧结时,Al2O3、Fe2O3、TiO2都能发生反应分别生成NaAlO2、Na2Fe2O4和难溶于水的CaTiO3。
请回答下列问题:
(1)Na2Fe2O4遇水便发生水解反应生成Fe(OH)3,写出Na2Fe2O4水解的化学方程式____________。
(2)浸出时再加入CaO的目的是______________________________________。
(3)浸出液中发生的生成Al(OH)3的离子方程式为____________________________________。
(4)滤液的主要成分是_________(写化学式);滤液循环使用的优点有________ (任答一点)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
已知2Na2SiO3+2NaAlO2+2H2O Na2Al2Si2O8↓+4NaOH,请回答下列问题:
Na2Al2Si2O8↓+4NaOH,请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为 。
(2)流程乙加入烧碱后Al2O3发生反应的离子方程式为 。
(3)固体X的主要成分是 ,过滤时使用的玻璃棒,其作用是 。
(4)滤液B中溶质的主要成分是 (填化学式);滤液E、K中溶质的主要成分是 (填化学式),写出该溶液的一种用途 。
(5)在流程中,选用CO2作酸化剂,为什么不选用盐酸? 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有100 mL NaOH溶液,先向其中逐渐通入一定量的CO2,随后向此溶液中逐滴加入4 mol/L的盐酸溶液,产生的CO2气体体积(标准状况下)与所加入盐酸溶液的体积之间的关系如图所示,试求: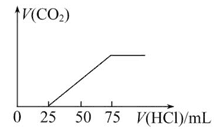
(1)NaOH在吸收CO2气体后,所得溶液中存在的溶质是:________,其物质的量是________。
(2)在加入盐酸情况下产生的CO2气体体积为(标准状况)________。
(3)原NaOH溶液的物质的量浓度是______________________________________;
若以Na2O2固体溶于水配得100 mL该溶液需Na2O2__________________________g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
固体化合物A,按下图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。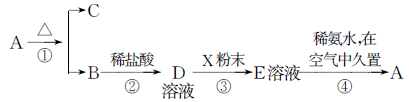
(1)写出下列物质的化学式:
A:__________,B:__________,D:__________,E:__________,X:__________。
(2)写出反应①的化学方程式:________________________________。
写出反应③的离子方程式: ________________________________。
写出反应④过程中,白色沉淀在空气中久置的化学方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
纯碱、烧碱等是重要的化工原料。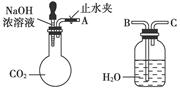
(1)利用上图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是 ,若其他操作不变,将A与C连接,可观察到的现象是 。
(2)向NaOH溶液中通入一定量CO2,结晶后得到白色固体,该白色固体的组成可能是
| A.NaOH和Na2CO3; | |
| B.; | |
| C.; | D.。 |
| 实验操作 | 实验现象 | 结论 |
| (1)取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | | |
| (2) | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com