
| A��һ����ѧ��Ӧ�Ƿ����ڳ����·�������÷�Ӧ�ġ�Hֵ�Ĵ�Сû�б�Ȼ��ϵ |
| B���к��ȡ�H����57.3kJ��mol��1������1.00L 1.00mol��L-1H2SO4��ϡ��NaOH��Һǡ����ȫ��Ӧ�ų�57.3kJ������ |
| C���õ������0.50mol��L��1���ᡢ0.55mol��L��1NaOH��Һ�����к��Ȳⶨ��ʵ�飬��ʹ��õ�ֵƫ�� |
| D����101kPaʱ��1molCH4��ȫȼ������CO2��ˮ�����ų���������CH4��ȼ���� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���٢ڢ� | B���ڢۢ� | C���٢ۢ� | D���٢ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��10:1 | B��1:10 | C��1:2 | D��2:1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��pH��5��CH3COOH��Һ��pH��5��NH4Cl��Һ�У�c(H��)��� |
| B��Na2CO3��Һ��ˮϡ�ͺָ���ԭ�¶ȣ�pH��Kw����С |
| C��pH=12��Ba(OH)2��Һ��pH=12��Na2CO3��Һ�У�ˮ�����c(H��)���ߴ� |
| D��0.1 mol��L��1CH3COONa��Һ�У�c(Na��)��c(CH3COO��)��c(H��)��c(OH��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ | B��ú̿ | C��ʯ�� | D������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
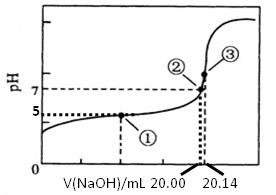
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
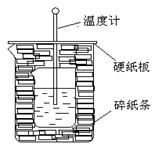
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ݢۢ٢ڢ� | B���ۢݢ٢ڢ� | C���ݢڢۢ٢� | D���ܢڢ٢ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��10��1 | B��5��1 |
| C��1��1 | D��1��10 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com