
����Ŀ��������Ԫ��X��Y��Z��W��ԭ�������������ӣ�����һ��Ϊ����Ԫ�ء�YԪ���ڴ����д������ֳ������ʣ�Z��X����ͬһ���壬q��r��s������ЩԪ����ɵĶ�Ԫ�����m��n��p�ֱ���Ԫ��Z��X��W�ĵ��ʣ�pͨ��Ϊ����ɫ���塣�������ʵ�ת����ϵ��ͼ��ʾ������˵����ȷ����

A. ������Z2Y2��X2Y2�л�ѧ����ȫ��ͬ
B. ����⻯��ķе㣺Y��W
C. 36g����q�����������r��Ӧ����2mol���ӷ���ת��
D. ��Y��Z��W����Ԫ����ɵĻ������ˮ��Һһ��������
���𰸡�B
�����������������������Ԫ��X��Y��Z��W��ԭ�������������ӣ�����һ��Ϊ����Ԫ�ء�YԪ���ڴ����д������ֳ������ʣ�YΪOԪ�أ�pͨ��Ϊ����ɫ���壬pΪ������WΪClԪ�أ�Z��X����ͬһ���壬��ZΪNaԪ�أ�XΪHԪ�أ���������ͼ��nΪ������rΪ�Ȼ��⣻qΪ�⻯�ƣ��⻯�ƺ��Ȼ��ⷢ��������ԭ��Ӧ����s���Ȼ��ƣ���������A��������Z2Y2��X2Y2�ֱ�Ϊ��������������ƣ����й������⺬�й��ۼ����������ƺ��й��ۼ������Ӽ�����A����B��ˮ���Ӽ��ܹ��γ�������е�����Ȼ��⣬��B��ȷ��C��36g�����⻯�Ƶ����ʵ���Ϊ![]() =1.5mol����������Ȼ��ⷴӦ����1.5mol���ӷ���ת�ƣ���C����D��������������ǿ�������Σ�ˮ��Һ�ʼ��ԣ���D����ѡB��
=1.5mol����������Ȼ��ⷴӦ����1.5mol���ӷ���ת�ƣ���C����D��������������ǿ�������Σ�ˮ��Һ�ʼ��ԣ���D����ѡB��


 �ݾ�ѵ������ϵ�д�
�ݾ�ѵ������ϵ�д� С����ȫ�ܼ��ϵ�д�
С����ȫ�ܼ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����д�ʩ�У����Ըı䷴Ӧ��ܵ����� ��
A������Ӧ��Ũ�� B��ʹ�ô��� C�������¶� D������ѹǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͨ����н��еĹ����������ʵ�����ʵ�飺
���� 

��������Ϊ��Fe�������������ɫ���ݣ�Һ���Ϸ���Ϊ����ɫ
��Fe���������������ɫ���ݺ�Ѹ��ֹͣ
��Fe��Cu�Ӵ�����������������ɫ����
����˵���в���ȷ������ ��
A��������������ɫ�����ɫ�Ļ�ѧ����ʽΪ��2NO+O2�T2NO2
B�����е�����˵��Fe�����γ����ܵ������㣬��ֹFe��һ����Ӧ
C���Ա�������������˵��ϡHNO3��������ǿ��ŨHNO3
D���������������Fe��Cu֮�����ӵ����ƣ����ж�Fe�Ƿ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��黯�����У���ѧ��������ȫ��ͬ���ǣ� ��
A��NaOH��NaClO��Na2O
B��HCl �� HClO��MgCl2
C��NH3��CO2��Na2O2
D��C2H6��H2O2��C2H5OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ǹ��������ӷ������ྦྷ��Ĺ������̡�

��1���ö��Ե缫��ⱥ��ʳ��ˮ��д��������X��Z��Ӧ�Ļ�ѧ����ʽ ��
��2���ںϳ�SiHCl3�Ĺ����У����������ɸ�����SiCl4����֪�����ʵķе�ֱ�Ϊ57.6����31.8�������ᴿSiHCl3�ķ����� ��
��3��SiHCl3�ᴿ����H2��ԭ��SiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g)����ͬ�¶ȼ���ͬ
Si(s)+3HCl(g)����ͬ�¶ȼ���ͬ![]() ʱ����Ӧ��X��ƽ��ת���ʹ�ϵ��ͼͼ20-1��ʾ��
ʱ����Ӧ��X��ƽ��ת���ʹ�ϵ��ͼͼ20-1��ʾ��
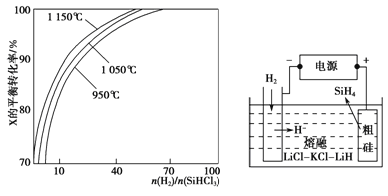
X�� ������H2������SiHCl3������
��������Ӧ��ƽ�ⳣ��K��1150���� K��950��������������������������=������
��4��SiH4�����飩�������ߴ��ྦྷ���Ƿdz�����ķ������ôֹ���ԭ�ϣ������ε�ⷨ��ȡ����ԭ����ͼ20-2��ʾ�����ʱ�����ĵ缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ���й�Ӧ�õ������У���ȷ����
A�������ȼ����Ϊ890��3kJ��mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��
CH4��g��+2O2��g��=CO2��g��+2H2O��g�� ��H= -890��3kJ��mol-1
B����֪ǿ����ǿ����ϡ��Һ�ﷴӦ���к���Ϊ57��3 kJ��mol-1�� ��1/2 H2SO4��aq��+1/2 Ba��OH��2��aq��= 1/2BaSO4��s��+H2O��l�� ��H= -57��3 kJ��mol-1
C�� 500�桢30MPa�£���0��5mol N2��1��5molH2�����ܱյ������г�ַ�Ӧ����NH3��g��������19��3kJ�� ���Ȼ�ѧ����ʽΪ��N2��g�� + 3H2��g��![]() 2NH3��g�� ��H= -38��6kJ��mol-1
2NH3��g�� ��H= -38��6kJ��mol-1
D����֪25�桢101KPa�����£�4Al��s����3O2��g����2A12O3��s�� ��H����2834��9 kJ��mol-1,
4Al��s����2O3��g����2A12O3��s�� ��H����3119��1 kJ��mol-1�� ��O2��O3�ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.��ͼ��ʾ��ͨ��5 min����������2.16 g����ʱCuSO4ǡ�õ���ꡣ��A����ԭ�����Һ�����Ϊ200mL��

��1����ԴFΪ________����������Ϊ________����A��Ϊ________�ء�
��2��A���е������ϵĵ缫��ӦʽΪ______________________________��
��3��ͨ��ǰA����ԭ�����ҺCu2+��Ũ��Ϊ____ ____��
������1����N2H4��һ����ȼ�ϵ����һ�ּ��Ի�����أ��õ�طŵ�ʱ�������ķ�ӦʽΪ ��
��2����ͼװ���м��ձ�ʢ��100 mL 0.2 mol/L��NaCl��Һ�����ձ�ʢ��100 mL 0.5 mol/L��CuSO4��Һ����Ӧһ��ʱ���ֹͣͨ�硣����ձ��е��뼸�η�̪���۲쵽ʯī�缫�������ȱ�죬ͨ��һ��ʱ�������Һ�л���CuSO4������Ҫʹ���ձ��е������Һ�ָ������ǰ��״̬���ɼ��� ���������.

A��CuO B��Cu��OH��2 C��CuCO3 D��Cu2��OH��2CO3
��3�����ڱʼDZ����Եļ״���CH3OH��ȼ�ϵ�أ����ӽ���Ĥ�����������Һ��Ϊ500mL 2 mol/LH2SO4 ��Һ�����������1mol e������ת��ʱ������������Һ������֮��Ϊ ������������ܽ⣬���跴Ӧ����ȫ�ľ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѪҺ��Ca2+��Ũ��һ�����mg/cm3����ʾ����ȡһ�������Ѫ�����������IJ����[��NH4��2C2O4]��Һ������������ƣ�CaC2O4�����������˲���Ƴ���ϴ�Ӻ�����ǿ��ɵò��ᣨH2C2O4��������KMnO4��Һ�ζ����ɲⶨѪҺ��Ʒ��Ca2+��Ũ�ȣ�ij�о���ѧϰС���������ʵ�鲽��ⶨѪҺ��Ʒ��Ca2+��Ũ�ȣ�
������������KMnO4����Һ��
��ͼ������50 mL����KMnO4����Һ�Ĺ���ʾ��ͼ��

��1�� ����۲�ͼʾ�ж����в���ȷ�IJ����� (�����)��
��2�� ����ȷ��50 mL��Һ����������� (������)��
��3�� �������ͼʾ�IJ��������Ƶ���Һ����ʵ�飬��������������ȷ������£�����õ�ʵ������ (����ƫ��������ƫС��)��
�� ���ⶨѪҺ��Ʒ��Ca2����Ũ�ȡ�
��ȡѪ��20.00 mL����������������õ����ᣬ����0.020 mol/L����KMnO4��Һ�ζ���ʹ����ת����CO2�ݳ�����ʱ������12.00 mL����KMnO4��Һ��
��4�� ��֪���������KMnO4��Һ��Ӧ�����ӷ���ʽΪ��2MnO![]() ��5H2C2O4��6H��===2Mnx����10CO2����8H2O
��5H2C2O4��6H��===2Mnx����10CO2����8H2O
��ʽ�е�x��______________��
��5�� �ζ�ʱ����������__________________������ȷ����Ӧ�ﵽ�յ㡣
��6�� �������㣬ѪҺ��Ʒ��Ca2����Ũ��Ϊ________mg/cm3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A��H2SO4��CH3CH2OH��CH3COONa��CaO�ֱ������ᡢ��κ�������
B�����ǡ����ᱵ��ˮ�ֱ����ڷǵ���ʡ�ǿ����ʺ��������
C��Mg��Al��Cu���Էֱ����û�����ֱ�Ӽ��ȷ��͵�ⷨұ���õ�
D���ճ���������ˮ�Ҵ�������ɱ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com