
[物质结构与性质]碳是形成化合物种类最多的元素。
(1)CH2=CH—C≡N是制备腈纶的原料,其分子中σ键和π键的个数之比为________(填最简整数比),写出该分子中所有碳原子的杂化方式:________________。
(2)乙醇(CH3CH2OH)和二甲醚(CH3OCH3)的分子式均为C2H6O,但CH3CH2OH的沸点高于CH3OCH3的沸点,其原因是_______________________________。
(3)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为________________。
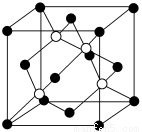
(4)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能。如图所示为碳化硅的晶胞(其中 为碳原子,
为碳原子,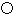 为硅原子)。每个碳原子周围与其距离最近的硅原子有________个。设晶胞边长为a cm,密度为b g·cm-3,则阿伏加德罗常数可表示为________(用含a、b的式子表示)。
为硅原子)。每个碳原子周围与其距离最近的硅原子有________个。设晶胞边长为a cm,密度为b g·cm-3,则阿伏加德罗常数可表示为________(用含a、b的式子表示)。
(1)2∶1 sp2、sp (2)乙醇分子之间形成氢键
(3)3d84s2 (4)4 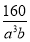
【解析】(1)凡单键均为σ键,双键中有1个σ键和1个π键,三键中有1个σ键和2个π键,故CH2=CH—C≡N中含有6个σ键,3个π键,故σ键和π键的个数之比为2∶1。分子中所有碳原子的价电子均参与形成了共价键,第一个和第二个碳原子有3个σ键,采取sp2杂化,而第三个碳原子只有2个σ键,采取sp杂化。
(2)乙醇分子之间可形成氢键,故其沸点较高。
(3)基态碳原子的未成对电子数为2个,故第四周期第Ⅷ族元素的基态原子有2个未成对电子,其基态价层电子排布式为3d84s2。
(4)由题意碳化硅的结构与金刚石类似,则每个碳原子周围与其距离最近的硅原子应为4个。每个晶胞含有碳原子和硅原子各4个,故每个晶胞的质量为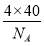 g,每个晶胞的体积为a3 cm3,则
g,每个晶胞的体积为a3 cm3,则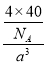 =b g·cm-3,可得NA=
=b g·cm-3,可得NA=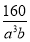


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源:2014年高考化学苏教版一轮复习2-1物质的分类与转化 分散系练习卷(解析版) 题型:选择题
英国物理学家约翰·丁达尔首先发现了入射光透过胶体时,从侧面可以看到一条光亮的通路。下列液体中,不会出现丁达尔效应的分散系的是 ( )。
①鸡蛋白溶液;②水;③淀粉溶液;④硫酸钠溶液;⑤沸水中滴入饱和FeCl3溶液;⑥肥皂水
A.② B.①③ C.⑤⑥ D.④
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习1-1-1化学实验仪器及操作练习卷(解析版) 题型:选择题
下列有关仪器的名称、图形、用途与使用操作的叙述均正确的是 ( )。
ABCD
名称250 mL
容量瓶分液漏斗酸式滴定管冷凝管
图形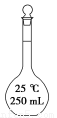



用途
与使
用操
作 配制1.0 mol·L-1 NaCl溶液,定容时仰视刻度,则配得的溶液浓度小于1.0 mol·L-1用酒精萃取碘水中的碘,分液时,碘层需从上口放出可用于量取10.00 mL
Na2CO3溶液蒸馏实验中将蒸气冷凝为液体
查看答案和解析>>
科目:高中化学 来源:2014年高考化学考前题型专练 保温训练(三)(解析版) 题型:填空题
现有几种有机物之间的转化关系如图所示(部分产物和条件省略),已知A为氯代醇。
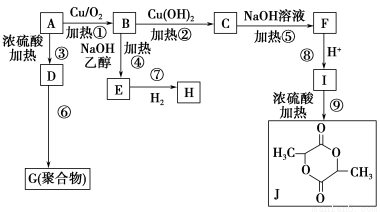
请根据上述信息,回答下列问题:
(1)A的结构简式为________。
(2)上述流程中,有机反应类型相同的是________。
A.①② B.③④ C.⑤⑨ D.⑦⑧
(3)下列有关E的说法正确的是________。
A.E属于二元醇
B.E能与钠反应产生气体
C.E能使溴的四氯化碳溶液褪色
D.E能发生银镜反应
(4)I有多种同分异构体,写出同时满足下列条件的I的所有同分异构体的结构简式____________________________________________________________。
①能水解且能与新制氢氧化铜反应生成砖红色固体;②能与钠反应放出气体。
(5)写出反应⑤的化学方程式:___________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学考前题型专练 保温训练(三)(解析版) 题型:填空题
已知A~F六种常见物质中,B是空气的主要成分之一,其他均是常见的化合物,其中E是一种常见的溶剂,F是一种温室气体。它们之间的转化关系如图所示。下列说法中正确的是 ( )。
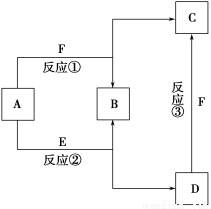
A.化合物A是一种碱性氧化物
B.图中①②③三个反应均为氧化还原反应
C.化合物D是一种强碱
D.化合物C的水溶液呈酸性
查看答案和解析>>
科目:高中化学 来源:2014年高考化学考前题型专练 保温训练(一)(解析版) 题型:选择题
Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示。该电池工作时总反应式为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则下列说法错误的是 ( )。
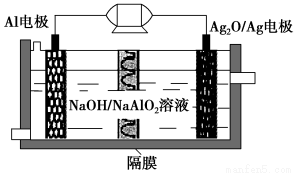
A.工作时正极发生还原反应
B.当电极上生成1.08 g Ag时,电路中转移的电子为0.01 mol
C.Al电极的反应式为Al-3e-+4OH-=AlO2—+2H2O
D.工作时电解液中的Na+透过隔膜移向Al电极
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第9练非金属及其化合物练习卷(解析版) 题型:实验题
常温常压下,O3为淡蓝色有特殊臭味的气体,工业上常用O3作为造纸、纺织等行业的漂白和脱色剂,也可用作饮用水的消毒和杀菌剂,但O3浓度超标时会因其强氧化性而对人体产生毒副作用。自然条件下打雷时空气中会有部分O2转化为O3。
实验室现提供以下装置和药品,请你完成O3的制备及性质验证实验。
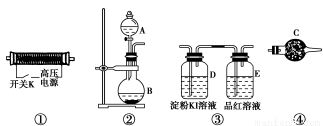
请回答以下问题:
(1)以上装置的连接顺序为______接______接________接________。
(2)A中应装入的试剂为________(写化学式);B中发生反应的化学方程式为____________________________________________________。
(3)检验整个装置的气密性的具体操作是__________________________。
(4)实验开始时,取下分液漏斗的塞子,断开电源开关K,再旋开分液漏斗的活塞,持续通入气体一段时间,其目的是________、________。然后合上电源开关K,试预测下列装置中可能观察到的现象及对应的结论。
D装置中:___________________________________________________;
E装置中:____________________________________________________。
(5)请指出该实验装置中的不妥之处并改进:_________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第8练金属及其化合物练习卷(解析版) 题型:选择题
下列各组物质按下图所示转化关系每一步都能一步实现的是( )
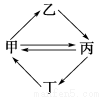
甲乙丙丁
AFeCl3FeCl2Fe2O3Fe(OH)3
BCuCuOCuSO4CuCl2
CNOHNO3NO2NH3
DAl(OH)3NaAlO2Al2O3AlCl3
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第4练物质结构与元素周期律练习卷(解析版) 题型:填空题
(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:

①第ⅡA族元素的价电子数________。
②第三周期元素的最高正价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
①N的最高价氧化物对应的水化物的化学式为_______________。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,A溶液中水的电离程度比B溶液中水的电离程度小。则化合物A中的化学键类型为________,B的化学式为________。
③工业上制取单质M的化学方程式为____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com