
����Ŀ��ij�о���ѧϰС����ȡ�κ���±��Ũ��Һ������Ca2+��Mg2+��Br-��SO42-��Cl-�ȣ�����ȡ�ϴ������Ȼ��ؾ��弰Һ�壬����������������̣�

�ش��������⣺
��1�������������ƣ�_____��Ҫ�ӳ�ɫҺ���з�����壬����ȡ�IJ�����Ҫ����Ҫ�����������ƾ��ơ��¶ȼơ������ܡ�ţ�ǹܣ������ܣ�����ƿ�⣬����Ҫ_____��
��2����֪�Լ�X��BaCl2��Һ��Y��KOH��Һ�����Լ�Z�Ļ�ѧʽΪ_____������SO42-�ѳ����ķ�����_____��
��3���������ľ���������裺����ҺD����_____�в��������ż��ϼ��ȣ�ͬʱ�ò��������Ͻ��裬ֱ��_____ʱ��ֹͣ���ȡ�
��4��ijͬѧ����ͼ��ʾ��ʵ��װ����ȡ������������ͨ���κ���±�С�

װ��b��ʵ���е�������_____����������װ���е�a��b��Ϊ����ķ������ռ�װ�ã�װ��c������Ľ�������������ṩ��ҩƷ��������װ�û�������ȡ��������_____��
����NH3��Ũ��ˮ�ͼ�ʯ�ҡ� ����SO2��CuƬ��Ũ����
����NO��CuƬ��ϡ���� ������O2��MnO2��˫��ˮ
��������װ���е�a��b��ȡ���ռ�NO��Ӧ��װ��b��θĽ���_____��
���𰸡����� ������ƿ K2CO3 ȡ��ɫ��ҺD������BaCl2��Һ����û�а�ɫ��������SO42-�ѳ��� ������ �д����������� ��ֹ���� �� ��b��װ��ˮ
��������
���κ���±��Ũ��Һ��ȡҺ�壬Ҫ��Br-����Ϊ�嵥�ʣ�Ȼ����CCl4��ȡ���õ����CCl4��Һ������CCl4��Һ�壬���Բ�������ķ�����Ҫ�õ��ϴ������Ȼ��ؾ��壬���ȥ��������Ca2+��Mg2+��SO42-��Ca2+���Լ�K2CO3��Һʹ֮�γ�CaCO3��������ȥ��Mg2+���Լ���KOH��Һʹ֮�γ�Mg(OH)2��������ȥ��SO42-����ͨ������BaCl2��Һʹ֮�γ�BaSO4��������ȥ��Ϊ�˳����������ӣ������Լ����Թ���������BaCl2��ҺӦ����K2CO3֮ǰ���룬����������Ba2+�����ú�����CO32-��ȥ����������CO32-���������ӵ������ȥ��
��1���������Ǽ���������BaCl2��Һ��K2CO3��Һ��KOH��Һ��õ��������ѳ�������Һ���룬�ù��˵ķ�������ɫҺ�������CCl4�Ļ���Ҫ���з�����壬����������ķ����������������Ҫ����������������ƿ���ƾ��ơ��¶ȼơ������ܡ�ţ�ǹܡ���ƿ���ʴ�Ϊ�����ˣ�������ƿ��
��2�����Լ�X��BaCl2��Һ��Y��KOH��Һ�����Լ�Z��K2CO3��Һ���ܺ�Ca2+��Ba2+���ɰ�ɫ�����Ӷ���ȥCa2+��Ba2+��SO42-�ܺ�Ba2+���ɰ�ɫ�������ʼ���SO42-�ѳ����ķ�����ȡ��ɫ��ҺD������BaCl2��Һ����û�а�ɫ��������SO42-�ѳ������ʴ�Ϊ��K2CO3��ȡ��ɫ��ҺD������BaCl2��Һ����û�а�ɫ��������SO42-�ѳ�����
��3���������������Ȼ�����Һ�õ��Ȼ��ؾ��壬���������������Ȼ�����Һ��ͬʱ�ò��������Ͻ��裬ֱ�����ִ�������ʱ��ֹͣ���ȣ��������Ƚ�ʣ���ˮ�����ɡ��ʴ�Ϊ���������д�������������
��4������ͼ��ʾ��ʵ��װ����ȡ������������b�Ľ����̶ܶ������ܳ���������ֹ���������á���������װ���е�a��b��Ϊ����ķ������ռ�װ�ã�b�������ռ��ܶȱȿ���С�Ҳ��Ϳ����еijɷַ�Ӧ�����壬SO2��O2���ܶȱȿ�����NO���ԺͿ����е�������Ӧ���ʶ�������bװ���ռ���ֻ�а�������Ҫ�����������װ���е�a��b��ȡ���ռ�NO������NO������ˮ��������b��װ��ˮ����ˮ���ռ�NO���ʴ�Ϊ���٣���b��װ��ˮ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�ʾʽ�������(����)
A. Na���Ĺ����ʾʽ��![]() B. Na���Ľṹʾ��ͼ��
B. Na���Ľṹʾ��ͼ��![]()
C. Na�ĵ����Ų�ʽ��1s22s22p63s1 D. Na����Χ�����Ų�ʽ��3s1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ۺͻ���̿�Ļ������NaCl��Һʪ���������ͼ��ʾװ���У��������ĵ绯ѧ��ʴʵ�顣�����йظ�ʵ���˵����ȷ����

A. ���������ĵ缫��ӦʽΪFe3e![]() Fe3+
Fe3+
B. ����ʴ�����л�ѧ��ȫ��ת��Ϊ����
C. ����̿�Ĵ��ڻ�������ĸ�ʴ
D. ��ˮ����NaCl��Һ�������ܷ���������ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��[���ʽṹ������]
Cu2O�㷺Ӧ����̫���ܵ��������CuSO4��NaOH�Ϳ���Ѫ��Ϊԭ�ϣ����Ʊ�CuO��
��1��Cu2+��̬��������Ų�ʽΪ____��
��2��![]() �Ŀռ乹��Ϊ____����������������Cu2+��OH��Ӧ������[Cu(OH)4]2��[Cu(OH)4]2�е���λԭ��Ϊ____����Ԫ�ط��ţ���
�Ŀռ乹��Ϊ____����������������Cu2+��OH��Ӧ������[Cu(OH)4]2��[Cu(OH)4]2�е���λԭ��Ϊ____����Ԫ�ط��ţ���
��3������Ѫ��ķ��ӽṹ��ͼ1��ʾ��������̼ԭ�ӵĹ���ӻ�����Ϊ____���Ʋ⿹��Ѫ����ˮ�е��ܽ��ԣ�____������������ˮ������������ˮ������

��4��һ��Cu2O��������ͼ2���У�Cuԭ�ӵ���ĿΪ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D��E���ֶ�����Ԫ�أ�����A��B��C����ͬһ���ڣ�Aԭ�������p�ܼ��ĵ��������ڴ����ĵ���������Bԭ������������������ɶԵĵ��ӣ�D��Eԭ�Ӻ��ڸ��Ե�����������������ȣ�BԪ�ؿɷֱ���A��C��D��E����RB2�ͻ������֪��DB2��EB2�У�D��B��������Ϊ 7��8��E��B��������Ϊ1��1���Իش�
(1)д��DԪ�ػ�̬ԭ�ӵĵ����Ų�ʽ��__________________________��
(2)д��AB2�Ľṹʽ��___________________________________________________��
(3)B��C��Ԫ�صĵ�һ�����ܴ�С��ϵΪ______>______(��Ԫ�ط���)��ԭ����____________________��
(4)����VSEPRģ��Ԥ��C���⻯������幹��Ϊ____________������ԭ��C���ӻ��������Ϊ________��
(5)C�ĵ��ʷ����Цм�����ĿΪ______��B��D��Ԫ�ص���̬�⻯����ȶ��Դ�С��ϵΪ______>____(�ѧʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CH3CH2CH3 ��CH3CH2CH2CH3 ��CH3CH2CH2CH2CH3 ��![]()
�� ��CH3CH2CH2CH2CH2CH3
��CH3CH2CH2CH2CH2CH3
�������ʵķе㰴�ɸߵ��͵�˳�����е��ǣ� ��
A. �ޢۢܢݢڢ� B. �ޢۢڢ٢ܢ� C. �ݢܢޢۢڢ� D. �ޢݢܢۢڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҿ�����SO2��Cl2�ڻ���̿�Ĵ�����ȡһ����Ҫ���л��ϳ��Լ������ȣ�SO2Cl2�������õķ�Ӧװ������ͼ��ʾ�����ּг�װ��ʡ�ԣ�����֪SO2Cl2���۵�Ϊ-54.1�棬�е�Ϊ69.1�棬��ˮ�ܷ������ҵ�ˮ�ⷴӦ������ʪ���������������

��1��������SO2Cl2��SԪ�صĻ��ϼ�Ϊ__________��
��2������D��������___________��
��3���ҡ���װ����ȡԭ����Cl2��SO2��
����װ��F�г���Cl2����E����ʢ�ŵ���ҺΪ_____________������Һ�����ƣ���
�ڱ�װ�����Լ�X��Y����������_____________��
A 98%Ũ����+Cu B 70%H2SO4+Na2SO3 C ŨHNO3+Na2SO3
��4������װ�õ���ȷ����˳��Ϊ________��________������_______��_________���üס��ҡ�����ʾ�����ظ�ʹ�ã���
��5��Bװ���д�a��ͨ����ˮ��������_________��Cװ�õ�������_______________��
��6��SO2Cl2��ˮ�ܷ������ҵ�ˮ�ⷴӦ���������������SO2Cl2����ˮ�ⷴӦ�Ļ�ѧ����ʽΪ________��
��7������Ӧ���������������Ϊ1.12L����ת��Ϊ��״����SO2�����������ͨ������õ������Ļ�����5.13g��������ȵIJ���Ϊ______________��������λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������﮵�������͵���ɫ��Դ��أ�������������������¡�
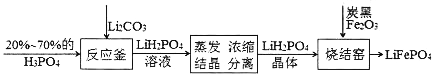
(1)��Ӧ���з�Ӧ�Ļ�ѧ����ʽΪ_______���÷�Ӧ���ֳ��ǽ����Թ�ϵ��P_____C(�>����<��)��
(2)�����£�LiH2PO4��Һ��pH��c(H2PO4-)�ı仯��ͼ1��ʾ��H3PO4��Һ��H2PO4-�ķֲ�����![]() ��pH�ı仯��ͼ2��ʾ[
��pH�ı仯��ͼ2��ʾ[![]() (��PԪ�ص�����)]��
(��PԪ�ص�����)]��
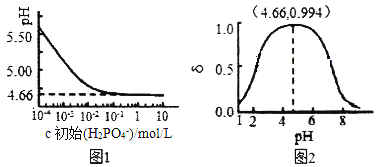
����ͼ1֪����Ũ��ʱLiH2PO4��Һ��pHС��7��������c��ʼ(H2PO4-)���������С��������Ľ���Ϊ__________________��
���ۺ���ͼ����������Ũ�ȴ���1mol/L��H3PO4��Һ�ܽ�Li2CO3��Ҫʹ��Ӧ���е�H3PO4����ȫ��ת����LiH2PO4����Ӧ������Ҫ������Һ��pH=________��
(3)������﮵���ܷ�ӦΪ��LiFePO4+6C![]() Li1-xFePO4+LixC6������еĹ������ʿɴ���Li+�����ʱ��Li+����______(���������������)���ŵ�ʱ��������ӦʽΪ__________________��
Li1-xFePO4+LixC6������еĹ������ʿɴ���Li+�����ʱ��Li+����______(���������������)���ŵ�ʱ��������ӦʽΪ__________________��
(4)������﮵�������ĺ�����ͨ�����·����ⶨ����ȡ1.60g�����������ܽ⣬����Һ�м����Թ�����SnCl2��Һ���ټ���HgCl2������Һ���ö�������������ָʾ������0.030mol/L�ظ������Һ�ζ�����Һ��dz��ɫ��Ϊ����ɫ�������ظ������Һ50.00mL��
��֪��2Fe3++Sn2++6Cl-=SnCl62-+2Fe2+
4Cl-+Sn2++2HgCl2=SnCl62-+Hg2Cl2
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
��ʵ���м���HgCl2������Һ��Ŀ����____________��
�����İٷֺ���Fe(��)=_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������(��Ҫ�ɷ�Fe2O3��SiO2��������Fe3O4��Al2O3��MgO)������ȫ��Ч��ˮ�������������(K2FeO4)�Ĺ����������£�

��֪��FeO42����ǿ������Һ���ȶ�������Fe(OH)3�������»ᷢ���ֽ⡣
(1)�������ʱ��������������˹����ԭ����_____��
(2)��������ʱ������Ӧ�����ӷ���ʽΪ_____��
(3)�ڿ��������������������£�̽������Fe2(SO4)3��NaOH���������䣬�ı��������ȶ�K2FeO4���ʵ�Ӱ�죬ʵ������ͼ��ʾ���������ȴ���0.55ʱK2FeO4�IJ����½���ԭ�������_____��

(4)������2����������������Ҫ�ɷ�Ϊ_____(�ѧʽ)��������3��������Һ�к��е���������OH����Cl����SO42����_____��_____(�ѧʽ)��
(5)K2FeO4�ɽ�ˮ�е�H2S����Ϊ�����Σ�ͬʱK2FeO4����ԭΪFe(OH)3����ӦʱK2FeO4��H2S�����ʵ���֮��Ϊ_____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com