
【题目】CoCO3是一种制造锂电池电极的原料。以含钴废渣(主要成分CoO、Co2O3,还含有Al2O3、 ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
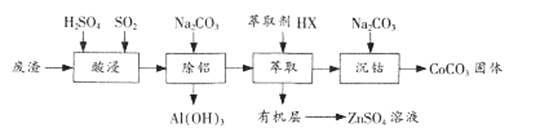
①相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)

②钴元素常见的化合价为+2、+3,+2钴有较强的还原性。
③+3钴的化合物一般呈现粉红—红色。
④Ksp[Co(OH)2]=1.58×10-15 Ksp[CoCO3]=1.4×10-13
(1)“酸浸”时通人SO2的目的是 ___________。
(2)“除铝”时调节溶液pH范围为 ________,该过程中主要反应的离子方程式为___________________。
(3)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是 ___________________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是 ___________________。
(4)“沉钴”时Na2CO3溶液需缓慢滴加的原因是 ____________________。
(5)CoCO3隔绝空气灼烧可以生成Co2O3,该反应的化学方程式为____________________。
(6)在CoCO3中先加入几滴丙酮,再边振荡边逐滴加入浓氨水,沉淀逐渐由粉红色变为土黄色的含Co(NH3)6 2+的溶液,向溶液中缓缓通入一定量的氧气,溶液最终变为红色。
①加入丙酮的作用__________________________;②若在该红色溶液中滴加足量的浓盐酸生成标准状况下2.24L C12,则之前往土黄色的溶液中至少应通入标准状况下__________________________升空气(空气中氧气体积分数为0.20)。
【答案】 将Co3+还原为Co2+ 5.0~5.4 ![]() 向有机层中加入适量的硫酸溶液充分振荡,静置,分液 防止加入过快而产生Co(OH)2沉淀
向有机层中加入适量的硫酸溶液充分振荡,静置,分液 防止加入过快而产生Co(OH)2沉淀 ![]() 保护+2钴不被空气中氧气氧化 5.6升
保护+2钴不被空气中氧气氧化 5.6升
【解析】试题分析:(1)SO2具有还原性;(2)“除铝”时只能让铝离子生成氢氧化铝沉淀,Co2+、Zn2+不能沉淀;该过程中铝离子与CO32-发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;(3)根据平衡移动原理分析由有机层获取ZnSO4溶液的操作;(4)Na2CO3溶液滴加过快,溶液PH大于7.6可生成Co(OH)2沉淀;(5)CoCO3隔绝空气灼烧可以生成Co2O3,根据化合价升降规律,钴元素化合价升高,碳元素化合价要降低,同时生成CO气体;(6)①丙酮可以隔绝氧气;②根据电子守恒计算通入空气的体积;
解析:(1)SO2具有还原性,“酸浸”时通人SO2可以将Co3+还原为Co2+;(2)“除铝”时只能让铝离子生成氢氧化铝沉淀,Co2+、Zn2+不能沉淀,所以“除铝”时调节溶液pH范围为5.0~5.4;该过程中铝离子与CO32-发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,反应的离子方程式是![]() ;(3)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)
;(3)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)![]() ZnX2(有机层)+H2SO4(水层),加入硫酸可使平衡逆向移动,所以由有机层获取ZnSO4溶液的操作是向有机层中加入适量的硫酸溶液充分振荡,静置,分液;(4)“沉钴”时Na2CO3溶液需缓慢滴加的原因是防止加入过快而产生Co(OH)2沉淀;(5)CoCO3隔绝空气灼烧可以生成Co2O3,根据化合价升降规律,钴元素化合价升高,碳元素化合价要降低,同时生成CO气体,反应方程式是
ZnX2(有机层)+H2SO4(水层),加入硫酸可使平衡逆向移动,所以由有机层获取ZnSO4溶液的操作是向有机层中加入适量的硫酸溶液充分振荡,静置,分液;(4)“沉钴”时Na2CO3溶液需缓慢滴加的原因是防止加入过快而产生Co(OH)2沉淀;(5)CoCO3隔绝空气灼烧可以生成Co2O3,根据化合价升降规律,钴元素化合价升高,碳元素化合价要降低,同时生成CO气体,反应方程式是![]() ;(6)①丙酮可以隔绝氧气,保护+2钴不被空气中氧气氧化;②根据电子守恒
;(6)①丙酮可以隔绝氧气,保护+2钴不被空气中氧气氧化;②根据电子守恒![]() ,设需要空气xL,则
,设需要空气xL,则
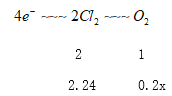
X=5.6L。


科目:高中化学 来源: 题型:
【题目】下列反应中,不属于取代反应的是( )
A.甲烷和氯气在光照下发生反应
B.苯和液溴在溴化铁的催化下发生反应
C.乙酸和乙醇在浓硫酸催化下发生反应
D.乙醇和金属钠发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下反应最符合绿色化学(原料原子全部转化为产品原子)要求的是
A.乙烯与水反应制乙醇 B.甲烷与氯气反应制备一氯甲烷
C.乙醇与乙酸反应制乙酸乙酯 D.皂化反应制肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,在pH=12的某溶液中,由水电离出来的OH-为( )
A.1.0×10-7 mol·L-1 B.1.0×10-6 mol·L-1
C.1.0×10-2 mol·L-1 D.1.0×10-12 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。

(1)加入的试剂①为______(填化学式),加入试剂①的目的是______。
(2)操作a的名称为过滤、洗涤,所需要的玻璃仪器为______。洗涤固体B的操作是________。
(3)固体E的成分为_____,加入的试剂④为_____,发生的化学方程式为_________。
(4)从溶液D和溶液G中得到FeSO47H2O晶体的操作为______、______、______、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同体积0.3 mol·L-1的H2SO4、HCl、HNO3、CH3COOH溶液中,加入足量的Zn,下列说法中正确的是
A.硫酸中放出氢气量最多 B.醋酸中放出氢气量最多
C.盐酸中放出的氢气量最多 D.只有盐酸和硝酸中放出的氢气量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,在浓度为1 mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测得其c(NH4+)分别为a、b、c(单位为mol/L),下列判断正确的是( )
A. a=b=c B. a > b >c C. a > c >b D. c > a > b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A是一种重要的化工原料,已知A在标准状况下的密度为1.25g·L-1,D是塑料的主要成分,据此回答下列有关问题:

(1)A的结构简式为__________。
(2)反应⑤的反应类型为__________。
(3)反应⑥的方程式为__________。
(4)下列说法不正确的是__________。
A.通过石蜡油的裂化可以得到多种A的同系物,如丙烯
B.反应⑨的条件是氯气、光照
C.反应⑦的反应类型为消去反应
D.反应④为加聚反应,得到的产物可使酸性高锰酸钾溶液褪色
E.得到C有多种途径,通过途径⑧⑨得到C,产率较低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com