
【题目】在25℃时,在浓度为1 mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测得其c(NH4+)分别为a、b、c(单位为mol/L),下列判断正确的是( )
A. a=b=c B. a > b >c C. a > c >b D. c > a > b
科目:高中化学 来源: 题型:
【题目】工业合成是一个需要经历多步反应的过程,我们常用的塑料包装绳(主要成分为聚氯乙烯 ![]() 就是通过多步反应生产出来的。现在有1,2-二溴乙烷,氢氧化钠醇溶液、二氧化锰、锌粒、稀硫酸,浓盐酸等主要原料,请您设计反应的步骤得到聚氯乙烯,将每一步反应的化学方程式写出:____________________________。
就是通过多步反应生产出来的。现在有1,2-二溴乙烷,氢氧化钠醇溶液、二氧化锰、锌粒、稀硫酸,浓盐酸等主要原料,请您设计反应的步骤得到聚氯乙烯,将每一步反应的化学方程式写出:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCO3是一种制造锂电池电极的原料。以含钴废渣(主要成分CoO、Co2O3,还含有Al2O3、 ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
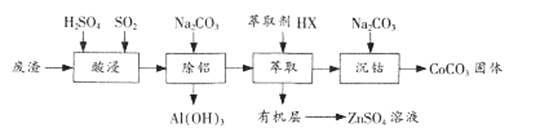
①相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)

②钴元素常见的化合价为+2、+3,+2钴有较强的还原性。
③+3钴的化合物一般呈现粉红—红色。
④Ksp[Co(OH)2]=1.58×10-15 Ksp[CoCO3]=1.4×10-13
(1)“酸浸”时通人SO2的目的是 ___________。
(2)“除铝”时调节溶液pH范围为 ________,该过程中主要反应的离子方程式为___________________。
(3)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是 ___________________。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是 ___________________。
(4)“沉钴”时Na2CO3溶液需缓慢滴加的原因是 ____________________。
(5)CoCO3隔绝空气灼烧可以生成Co2O3,该反应的化学方程式为____________________。
(6)在CoCO3中先加入几滴丙酮,再边振荡边逐滴加入浓氨水,沉淀逐渐由粉红色变为土黄色的含Co(NH3)6 2+的溶液,向溶液中缓缓通入一定量的氧气,溶液最终变为红色。
①加入丙酮的作用__________________________;②若在该红色溶液中滴加足量的浓盐酸生成标准状况下2.24L C12,则之前往土黄色的溶液中至少应通入标准状况下__________________________升空气(空气中氧气体积分数为0.20)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、M、Q、R六种元素均位于前四周期,且原子序数依次增大。其相关信息如下:X的核外电子总数等于其电子层数;Y的最外层电子数是次外层的3倍;Z原子的价层电子排布为nsn-1npn-2;Q的外围电子排布为(n+1)d4n(n+2)sn; W、M、R最外层电子只有1个。回答下列问题:
(1)Q元素位于周期表第_____族。Q金属配合物Q(CO)n的中心原子的价电子数与配体提供的电子总数之和为18,则n=_____。M的一种重要化合物用于检查司机是否酒驾,该化合物的化学式______,如果司机酒驾检查时该物质显示的颜色变化是_____________________。
(2)关于R单质晶体的说法正确的是______________。
①晶体中的化学键具有方向性和饱和性
②晶体中不存在阴阳离子间的相互作用
③晶体导电是因为在外加电场作用下产生自由电子
④单质具有光泽是因为金属阳离子吸收并放出可见光
⑤晶体中原子的堆积方式为‥ABCABC‥型。
(3)离子化合物中阴阳离子半径之比是决定晶体构型的重要因素之一,配位数与离子半径之比存在如下关系:

已知,在QY中Q离子的半径为70pm,Y离子的半径为140pm,分析以上信息,可以推导出该晶体结构与常见_______晶体(填写化学式)阴阳离子的配位数相同。与阴(阳)离子配位的这几个阳(阴)离子,在空间构成的立体形状为_______________。
(4)W的原子半径为r,其晶体的空间利用率______________(用含r的表达式表示)。
(5)已知SiH4在碱的催化作用下,剧烈发生水解,反应方程式为:SiH4 +(n+2)H2O= SiO2.nH2O + 4H2,已知每1mol SiH4水解反应中转移4mol电子,则C,H,Si三种元素的电负性由大到小的顺序为___________。
(6)X射线衍射测定发现,I3AsF6中存在I3+离子,I3+离子的几何结构为______,中心原子的杂化方式为_____
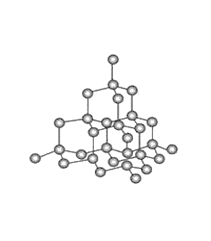
(7)已知金刚石中碳原子的连接方式如下图,则12g金刚石中含有的六元环的数目是________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温时HClO的Ka=3.0×10-8,HF的Kb=3.5×10-4。现将pH和体积都相同的次氯酸和氢氟酸溶液分別加蒸馏水稀释,pH随溶液体积的变化如图所示,下列叙述正确的是( )
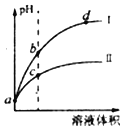
A. 曲线Ⅰ为次氯酸稀释时pH变化曲线
B. 取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗氢氟酸的体积较小
C. b点溶液中水的电离程度比c点溶液中水的电离程度小
D. 从b点到d点,溶液中![]() 保持不变(HR代表HClO或HF)
保持不变(HR代表HClO或HF)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】区别乙醇、苯和四氯化碳,最简单的方法是( )
A.加入金属钠,振荡,静置B.在有浓硫酸存在的条件下与乙酸加热
C.加蒸馏水后振荡,静置D.加硝酸银溶液后振荡,静置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬(Ⅵ)的化合物有较大毒性,如不回收利用,会对环境造成污染。某混合浆液含Al(OH)3、MnO2和少量Na2CrO4。某研究小组设计了如下电解分离装置,可以使浆液较完全地分离成固体混合物和含铬元素溶液,并回收利用。下列说法错误的是( )
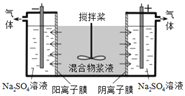
A. 通电后CrO42-将通过阴离子膜进入阳极室 B. 阴极室最终只能得到Na2SO4和H2
C. 阳极的电极反应式为:4OH--4e-=O2↑+2H2O D. 分离后所得含铬元素的粒子有CrO42-和Cr2O72-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生用如图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。请回答下列问题:
![]()
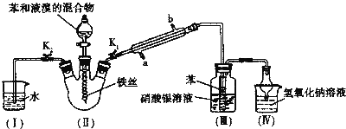
(1)冷凝管所起的作用为冷凝回流和导气,冷凝水从______口进入(填“a或“b”)。
(2)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。 Ⅲ中小试管内苯的作用是_____。能说明苯与液溴发生了取代反应的现象是_____。Ⅳ中球形干燥管的作用是_____。
(3)待三颈烧瓶中的反应进行到仍有气泡冒出时,关闭分液漏斗活塞,再_____,这样操作的目的是_____。(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子方程式或离子共存的叙述正确的是
A. 用肥皂(主要成份C17H35COONa)水检验含有较多钙离子的硬水:2C17H35COO-+Ca2+===(C17H35COO)2Ca↓
B. 将磁性氧化铁溶于氢碘酸:Fe3O4+8H+=2Fe3++Fe2++4H2O
C. 常温下,在![]() =0.1的溶液中:Na+、K+、SO42-、HCO3-能大量共存
=0.1的溶液中:Na+、K+、SO42-、HCO3-能大量共存
D. 在NaC1O溶液中:SO32-、OH-、C1-、K+能大量共存
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com