
 某研究性学习小组对还原铁粉与水蒸气的反应及产物进行科学探究.
某研究性学习小组对还原铁粉与水蒸气的反应及产物进行科学探究.
| ||
| 实验序号 | 实验操作 | 实验现象 |
| ① | 取少量残留黑色固体放入烧杯中,加入足量浓盐酸,微热 | 黑色固体逐渐溶解,有气泡产 生,溶液呈浅绿色. |
| ② | 向上述烧杯中滴加几滴KSCN溶 液,充分振荡 | 溶液没有出现红色 |
| 实验序号 | 实验操作 | 实验现象 |
| ① | 称取14.4g残留黑色固体放入烧杯中,加入足量浓盐酸,微热 | 黑色固体逐渐溶解,有气泡产生,溶液呈浅绿色. |
| ② | 向上述烧杯中加入足量的氯水,充分振荡 | 溶液呈黄色 |
| ③ | 向上述烧杯中加入足量NaOH溶液,过滤、洗涤、干燥、称量 | 得到21.4g红褐色固体 |
| 2.14g |
| 107g/mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、用100 mL的量筒量取18.8 mL NaOH溶液 |
| B、用瓷坩埚加热熔融NaOH |
| C、用托盘天平称取25.2 0g氯化钠 |
| D、用100 m L容量瓶制备7 0 mL0.1 mo l?L-1盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+(g)+Cl-(g)═NaCl(s);△H | ||
B、Na(s)+
| ||
| C、Na(s)═Na(g);△H2 | ||
| D、Na(g)-e-═Na+ (g);△H |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 10℃ | 20℃ | 30℃ |
| 溶解度(g/100g H2O) | 2.5 | 3.9 | 5.6 |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. | |
| 步骤2:取适量滤液于试管中,滴加稀硫酸. | ①若出现 |
| 步骤3:取适量步骤1中的沉淀于试管中,滴加盐酸,连接带塞导气管将产生的气体导入澄清石灰水. | ②若出现 |
| 步骤4:取步骤1中的滤液于烧杯中,用pH计测定其pH. | ③若pH_ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相 关 信 息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | Y元素的激发态原子的电子排布式为1s22s22p63s23p34s1 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
查看答案和解析>>
科目:高中化学 来源: 题型:
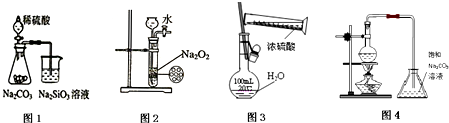
| A、图1 证明非金属性强弱:S>C>Si |
| B、图2 制备少量氧气 |
| C、图3 配制一定物质的量浓度的硫酸溶液 |
| D、图4 制备少量乙酸丁酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 实 验 | 分离Na2CO3溶液和CH3CH2OH | 除去Cl2中含有的少量HCl | 做Cl2对NaOH溶液的喷泉实验 | 制取少量氨气 |
| 装 置 或 仪 器 |  |  |  |  |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com