
有关苏打和小苏打的叙述正确的是 ( )
A.苏打和小苏打都既能与酸反应又能与氢氧化钠反应
B.与足量稀硫酸反应,生成等量的二氧化碳消耗的苏打的物质的量比小苏打多
C.向小苏打溶液中滴入氢氧化钡溶液无沉淀,而苏打溶液中滴入氢氧化钡溶液出现沉淀
D.等质量的苏打、小苏打分别与足量稀硫酸反应,小苏打产生的二氧化碳多
科目:高中化学 来源: 题型:
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
⑴工业上采用电解氧化铝-冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:
2Al2O3  4Al+3O2↑加入冰晶石的作用:_______________________________。
4Al+3O2↑加入冰晶石的作用:_______________________________。
⑵上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为 ,下列可作阴极材料的是________________。
A.铝材 B.石墨 C.铅板 D.纯铝

⑶阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式为__________________________________。
⑷在铝阳极氧化过程中,需要不断地调整电压,理由是____________ 。
⑸下列说法正确的是 。
A. 阳极氧化是应用原电池原理进行金属材料表面处理的技术
B. 铝的阳极氧化可增强铝表面的绝缘性能
C. 铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D. 铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
硅及其化合物在材料领域中应用广泛,下列叙述正确的是
A.硅单质是制造玻璃的主要原料
B.CaSiO3可用来制造太阳能电池
C.水泥的主要成分是Na2SiO3、CaSiO3和SiO2
D.二氧化硅是制造光导纤维的材料
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于钠及其化合物的叙述,正确的是( )
A.发酵粉中含有碳酸氢钠,能使焙制出的糕点疏松多孔
B.氧化钠可用于呼吸面具中作为氧气的来源
C.碳酸钠的水溶液呈中性
D.硫酸钠灼烧时火焰呈紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是:( )
A.元素的单质一定是由还原该元素的化合物来制得
B.含有最高价元素的化合物不一定具有很强的氧化性
C.阳离子只能得到电子被还原,阴离子只能失去电子被氧化
D.在化学反应中,得电子越多的氧化剂,其氧化性就越强
查看答案和解析>>
科目:高中化学 来源: 题型:
固体化合物A,按下图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。

(1)写出下列物质的化学式:
A:__________,B:__________,D:__________,E:__________,X:__________。
(2)写出反应①的化学方程式:________________________________。
写出反应③的离子方程式: ________________________________。
写出反应④过程中,白色沉淀在空气中久置的化学方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,水溶液中c(H+)与c(OH-)的变化关系如图中曲线a c所示,下列判断错误的是
A.a c曲线上的任意一点都有c(H+)·c(OH-)=10-14
B.b d线段上任意一点对应的溶液都呈中性
C.d点对应溶液的温度高于25℃,pH<7
D.CH3COONa溶液不可能位于c点
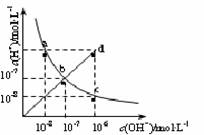
查看答案和解析>>
科目:高中化学 来源: 题型:
对于右图的锌锰电池,下列说法正确的是
A.MnO2是氧化剂,被氧化
B.碳棒为正极、锌筒为负极
C.放电过程中NH4+向锌极移动
D.负极反应为:Zn-2e-+2OH-==Zn(OH)2

查看答案和解析>>
科目:高中化学 来源: 题型:
试运用所学知识,回答下列问题:
(1)已知某反应的平衡表达式为: ,它所对应的化学方程式为:
,它所对应的化学方程式为:
(2)已知在400℃时,N2 (g)+ 3H2(g)  2NH3(g) △H<0 的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正 v(N2)逆(填:>、<、=、不能确定)
2NH3(g) △H<0 的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正 v(N2)逆(填:>、<、=、不能确定)
欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
A.缩小体积增大压强 B.升高温度 C.加催化剂 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:A(g) + 3B(g)  2C(g) + D(s)ΔH,其化学平衡常数K与温度t的关系如下表:
2C(g) + D(s)ΔH,其化学平衡常数K与温度t的关系如下表:
| t/K | 300 | 400 | 500 | … |
| K/(mol·L—1)2 | 4×106 | 8×107 | K1 | … |
请完成下列问题:
①判断该反应的ΔH 0(填“>”或“<”)
 ②在一定条件下,能判断该反应一定达化学平衡状态的是 (填序号)
②在一定条件下,能判断该反应一定达化学平衡状态的是 (填序号)
A.3v(B)(正)=2v(C)(逆) B.A和B的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)以天然气(假设杂质不参与反应) 为原料的燃料电池示意图如图所示。
为原料的燃料电池示意图如图所示。
①放电时,负极的电极反应式为:
②假设装置中盛装100.0 mL 3.0 mol·L—1 KOH溶液,放电时参与反应的氧气在标准状况下体积为8 960 mL。放电完毕后,电解质溶液中各离子浓度的大小关系为:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com