
【题目】标准状况下,某同学向100mL H2S饱和溶液中通入SO2 , 所得溶液pH变化如图所示.下列分析中正确的是( ) 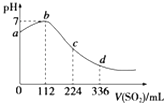
A.b点对应的溶液导电性最强
B.亚硫酸是比氢硫酸更弱的酸
C.ab段反应是SO2+2H2S═3S↓+2H2O
D.原H2S溶液的物质的量浓度为0.05molL﹣1
【答案】C
【解析】解:A.b点为中性,只有水,导电性最差,故A错误;
B.根据图象可知恰好反应时消耗二氧化硫112mL,n(SO2)= ![]() =0.005mol,根据方程式可知原溶液中硫化氢为0.01mol,通入336mL二氧化硫时,溶液中亚硫酸为0.01mol,亚硫酸的浓度与原氢硫酸浓度相等,二者都是二元酸,溶液中亚硫酸pH值更小,故亚硫酸的酸性比氢硫酸更强,故B错误;
=0.005mol,根据方程式可知原溶液中硫化氢为0.01mol,通入336mL二氧化硫时,溶液中亚硫酸为0.01mol,亚硫酸的浓度与原氢硫酸浓度相等,二者都是二元酸,溶液中亚硫酸pH值更小,故亚硫酸的酸性比氢硫酸更强,故B错误;
C.ab段pH在增大,由酸性到中性,则发生的反应是SO2+2H2S=3S↓+2H2O,故C正确;
D.由图可知,112mLSO2与硫化氢恰好完全反应,则n(SO2)= ![]() =0.005mol,由方程式可知n(H2S)=0.01mol,则原H2S溶液的物质的量浓度为
=0.005mol,由方程式可知n(H2S)=0.01mol,则原H2S溶液的物质的量浓度为 ![]() =0.1mol/L,故D错误.
=0.1mol/L,故D错误.
故选C.
H2S 饱和溶液中通入SO2 , 发生反应:SO2+2H2S=3S↓+2H2O,随着反应的进行,溶液酸性逐渐减弱,但恰好反应时,溶液呈中性,二氧化硫过量,与水反应生成亚硫酸,溶液酸性逐渐增强,根据图象可知恰好反应时消耗二氧化硫112mL,根据方程式可知原溶液中硫化氢为0.01mol,通入336mL二氧化硫时,亚硫酸的浓度与原氢硫酸浓度相等,二者都是二元酸,溶液中亚硫酸pH值更小,故亚硫酸的酸性更强,以此解答该题.


科目:高中化学 来源: 题型:
【题目】(1)现有下列十种物质:①蔗糖②熔融NaCl③石墨④铜丝⑤NaOH固体⑥SO2⑦NaHSO4固体⑧K2O固体⑨液态H2SO4⑩饱和FeCl3溶液 上述物质中可导电的是________(填序号,下同);上述物质中不能导电,但属于电解质的是_______________________。
(2)NaHSO4是一种酸式盐,请填写下列空白:
①NaHSO4晶体熔化时的电离方程式为______________________________。
②3 mol·L-1 NaHSO4与2 mol·L-1 Ba(OH)2溶液等体积混合,该反应总的离子方程为___________。
(3)实验室制备少量Fe(OH)3胶体所用的物质有__________(填序号),反应的离子方程式为________________________________________________。
(4)某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO4-、H2O、Mn2+、H2O2、H+,已知该反应中H2O2只发生了如下过程:H2O2→O2。写出该反应的离子方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究.
(1)提出假设
①该反应的气体产物是CO2 .
②该反应的气体产物是CO.
③该反应的气体产物是 .
(2)设计方案
如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比.
查阅资料
氮气不与碳、氧化铁发生反应.实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气.请写出该反应的离子方程式: .
(3)实验步骤
①按图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气.冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g.
步骤②、④中都分别通入N2 , 其作用分别为 .
(4)数据处理
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式: .
(5)实验优化
学习小组有同学认为应对实验装置进一步完善.
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是 .
②从环境保护的角度,请你再提出一个优化方案将此实验装置进一步完善: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种。当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如下图1所示。请填写下列空白:
(1)在该溶液中含有的离子是_____________,物质的量浓度之比为_______________。
(2)所加的淡黄色固体是________________(化学式)。

(二)黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1 g该黄铁矿石的样品放入如图2装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为:![]()
【实验一】:测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:

(3)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是(用化学方程式表示)________________________________________。
(4)该黄铁矿石中硫元素的质量分数为______________(列出表达式即可)。
【实验二】:测定铁元素的含量

(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_________________。
(6)某同学一共进行了三次滴定实验,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+) =_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( ) 
A.该硫酸的物质的量浓度为9.2 mol/L
B.1 mol Zn与足量该硫酸反应产生2 g氢气
C.配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL
D.该硫酸与等质量的水混合后所得溶液的浓度大于9.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年北京奥运会的“祥云”火炬所用燃料的主要成分是丙烷,下列有关丙烷的叙述正确的是( )
A. 丙烷的分子式是C3H6
B. 丙烷分子中的碳原子在一条直线上
C. 丙烷在光照条件下能够与Cl2发生取代反应
D. 丙烷在常温下呈液态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z是周期表中相邻的三种短周期元素,X和Y同周期,Y和Z同主族,三种元素原子的最外层电子数之和为17,核内质子数之和为31,则X、Y、Z是 ( )
A. Mg Al Si B. Li Be Mg C. N O S D. P S O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com