硫及其化合物在国民生产中占有重要的地位.
(1)为实现废旧印刷线路板综合利用,可用H
2O
2和稀H
2SO
4的混合液溶解处理产生的铜粉末,以制备硫酸铜.已知:
①Cu(s)+2H
+(aq)+
O
2(g)=Cu
2+(aq)+H
2O(l)△H=-221.45kJ?mol
-1②2H
2O
2(l)=2H
2O(l)+O
2(g)△H=-196.46kJ?mol
-1Cu与H
2O
2和稀H
2SO
4的混合液反应生成Cu
2+和H
2O的热化学方程式为
Cu(s)+2H+(aq)+H2O2(l)=Cu2+(aq)+2H2O(l)△H=-319.68kJ?mol-1
Cu(s)+2H+(aq)+H2O2(l)=Cu2+(aq)+2H2O(l)△H=-319.68kJ?mol-1
,当有1mol H
2O
2参与反应时,转移电子的物质的量为
2
2
mol.
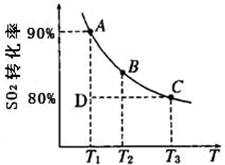
(2)硫酸工业生产中涉及如下反应:2SO
2(g)+O
2(g)?2SO
3(g),一定条件下,SO
2的平衡转化率和温度的关系如图所示.该反应的△H
<
<
0(填“>”、“<”). 反应进行到状态D时,υ
正>
>
υ
逆(填“>”、“<”或“=”).
(3)某温度时,将4mol SO
2和2mol O
2通入2L密闭容器中,10min时反应达到平衡状态,测得SO
3的浓度为1.6mol?L
-1,则0~10min内的平均反应速率υ(SO
2)=
80 L?mol-1
80 L?mol-1
,该温度下反应2SO
2(g)+O
2(g)?2SO
3(g)的平衡常数K=
0.16mol?L-1?min-1
0.16mol?L-1?min-1
.
如改变条件使上述反应的平衡常数K值增大,则该反应
ad
ad
(填写序号)
a.反应一定正向移动 b.反应一定逆向移动
c.改变的条件可能是浓度或压强 d.移动时逆反应速率由小到大.

 硫及其化合物在国民生产中占有重要的地位.
硫及其化合物在国民生产中占有重要的地位.

 (2012?淄博一模)硫及其化合物在国民生产中占有重要的地位.
(2012?淄博一模)硫及其化合物在国民生产中占有重要的地位.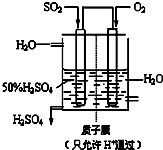
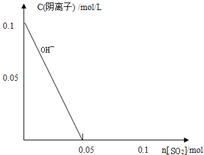
 硫及其化合物在自然界中广泛存在,运用相关原理回答下列问题:
硫及其化合物在自然界中广泛存在,运用相关原理回答下列问题: