
【题目】氯气跟下列物质反应时,能够产生白雾的是
A.NaB.CuC.H2D.Fe
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素。下列说法正确的是
A. 原子半径:![]()
B. Y和Z的简单氢化物的沸点:Y的氢化物![]() 的氢化物
的氢化物
C. Y的单质的氧化性比Z的强
D. X、Y、Z 三种元素可以组成共价化合物和离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3![]() 2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
A. 5∶3 B. 5∶4 C. 1∶1 D. 3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,冰醋酸加水稀释过程中溶液的导电能力有如图所示曲线,请回答。
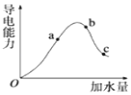
①a、b、c三点的氢离子浓度由小到大的顺序为______。
②a、b、c三点中,醋酸的电离程度最大的一点是______。
③测得某醋酸溶液中氢离子浓度为0.004molL﹣1,则醋酸的电离度为_____,该温度下醋酸的电离平衡常数K=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
以芳香烃A为原料发生如下图所示的变化,可以合成两种高聚物G和H。已知:两个羟基连在同一碳原子上不稳定,会自动脱水。

回答下列问题:
(1)A 中官能团的名称是_____________;C的结构简式为_____________。
(2)B→C的反应条件是____________,D→E的反应类型是_______________。
(3)写出E→G 的化学方程式:_____________________。
(4)E的同分异构体中,苯环上有4 个取代基、遇FeCl3溶液显紫色且能与碳酸氢纳溶液反应生成 CO2的共 有__________种(不考虑立体异构),其中核磁共振氢谱显示有4 种不同化学环境的氢的结构简式为_____________(写出一种即可)。
(5)参照上述合成路线,以丙炔为原料(无机试制任选),设计可降解塑料聚乳酸(PLA)的合成路线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
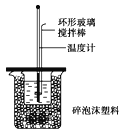
(1)大小烧杯间填满碎纸条的作用是______;
(2)大烧杯上如不盖硬纸板,求得的中和热数值将___(填“偏大”、“偏小”或“无影响”),结合日常生活的实际该实验在____进行效果更好;
(3)实验中改用60mL0.50molL﹣1盐酸与50mL0.55molL﹣1NaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等”、“不相等”),简述理由:_____;
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会_____;用50mL 0.5mo1L﹣1NaOH溶液进行上述实验,测得的中和热的数值会____(填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按图下装置进行制取。
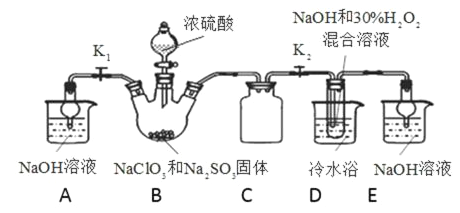
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,38-60℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是__________________________________。
(2)B中产生的ClO2是__________(填“氧化产物”或“还原产物”)。
(3)装置D中反应生成NaClO2的化学方程式为____________________________。反应后的溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH—外还可能含有SO42-,检验SO42-离子的方法是________________。
实验Ⅱ:样品杂质分析与纯度测定
(4)测定样品中NaClO2的纯度。测定时进行如下实验:准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是__________________________________________________。
②所称取的样品中NaClO2的物质的量为______________(用含c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 某气体能使品红溶液褪色,则该气体是SO2
B. 等质量的铜按a,b两种途径完全转化为硝酸铜,途径a,b消耗的硝酸一样多:途径a:Cu![]() CuO
CuO![]() Cu(NO3)2;途径b:Cu
Cu(NO3)2;途径b:Cu![]() Cu(NO3)2
Cu(NO3)2
C. 用分别蘸有浓氨水和浓盐酸的玻璃棒相互靠近会产生白烟,也可用浓硫酸代替浓盐酸
D. 把过量Cu放入少量的稀硝酸中至完全反应后,再加入稀硫酸可以产生气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com