
����Ŀ������˵����ȷ���ǣ� ��
A. ij������ʹƷ����Һ��ɫ�����������SO2
B. ��������ͭ��a��b����;����ȫת��Ϊ����ͭ��;��a��b���ĵ�����һ���ࣺ;��a��Cu![]() CuO
CuO![]() Cu(NO3)2��;��b��Cu
Cu(NO3)2��;��b��Cu![]() Cu(NO3)2
Cu(NO3)2
C. �÷ֱ�պ��Ũ��ˮ��Ũ����IJ������������������̣�Ҳ����Ũ�������Ũ����
D. �ѹ���Cu����������ϡ����������ȫ��Ӧ���ټ���ϡ������Բ�������
���𰸡�D
��������
A����ʹƷ����Һ��ɫ�����岻һ����SO2��������Ϊ�����ȣ���A����
B����������1molCu��NO3��2��;��a������2molHNO3��;��b����8/3molHNO3�����������ͭ��a��b����;����ȫת��Ϊ����ͭ��;��a��b���ĵ����ͬ����B����
C.Ũ���������ѻӷ����ᣬպ��Ũ��ˮ��Ũ����IJ��������������������̣���C����
D.ϡ������ͭ��Ӧ��������ͭ��NO�����ˮ����Ӧ�����ټ�ϡ���ᣬCu�������ӡ���������ӷ�Ӧ����ͭ���ӡ�NO��ˮ����D��ȷ��
�𰸣�D


 ����������ϵ�д�
����������ϵ�д� �Ż���ҵ�Ϻ��Ƽ����׳�����ϵ�д�
�Ż���ҵ�Ϻ��Ƽ����׳�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ�е������仯�����б�������ȷ����(����)
A. ���ȷ�Ӧ�У���Ӧ�������������������������� B. �Ͽ���ѧ���Ĺ��̻�ų�����
C. ���Ȳ��ܷ����ķ�Ӧһ�������ȷ�Ӧ D. ������ԭ��Ӧ��Ϊ���ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ģ��ȼ��ⱥ��ʳ��ˮ��ȡNaOH�Ĺ�������ʾ��ͼ����
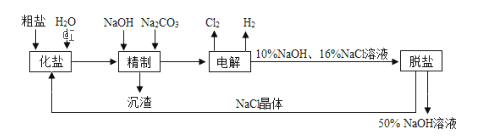
��1�������к�CaCl2��MgCl2�����ʣ�д�����ƹ����з�����Ӧ�����ӷ���ʽ��________��________��
��2�����������SO42�������ϸߣ��������ӱ�ʽ����ȥSO42�� ���ñ��Լ�������____
A.Ba��OH��2B.Ba��NO3��2C.BaCl2
��3������������������Ӧ�Ļ�ѧ����ʽΪ________�����Դ���������ĵ缫����������������________������������ʹ�õ���ֽ�������ǣ�
��4���ȼ���������������������Խ�һ�������������ᣬ��Ҫ�������£�
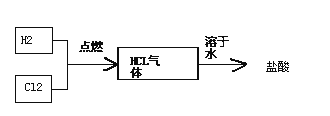
���йؼ���һ��Ϊ������������ȼ�չܿ�ȼ������HCl�������ж���Ӧ��ȡ�Ĵ�ʩ��________���ϳ����᳧Ҫ��ϳ����е�HCl�ĺ���Ҫ����97%����������ķ������з����Ƿ�������97%________��
��5���ȼ������������������������Һ����������ȡ��84����Һ������Ӧ�Ļ�ѧ����ʽΪ________��
��6��ijͬѧ��֤���������Ȼ����������ʲ�ͬ�����ֱ���A��B��C��֧�ྻ�Թ��и�����һƬ�������ɫʯ����ֽ��Ȼ����A�Թ��ڼ������ᣬ��ֽ��________ɫ����B�Թ���ͨ�������Ȼ������壬��ֽ��________ɫ�������C�Թ��м�������________���ѧʽ������֮���Լ����������ʵ�������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡ������ɫʯ����ֽʪ������ڲ���Ƭ�ϣ�Ȼ��˳��ֱ�μ�65%������Һ��98%��������Һ��������ˮ��������ֽ���ձ��(����)
A. �ס��졢�� B. �졢�ڡ���
C. �졢�졢�� D. �ס��ڡ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и�������һ������ָ����Һ�д����������(����)
A. ![]() ��1��10��13 mol��L��1����Һ�У�NH
��1��10��13 mol��L��1����Һ�У�NH![]() ��Ca2����Cl����NO
��Ca2����Cl����NO![]()
B. ʹ��̪���ɫ����Һ�У�Na����Al3����SO![]() ��Cl��
��Cl��
C. ��Al��Ӧ�ܷų�H2����Һ�У�Fe2����K����NO![]() ��SO
��SO![]()
D. ˮ�����c(H��)��1��10��13 mol��L��1����Һ�У�K����Na����AlO![]() ��CO
��CO![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�����м׳ص��ܷ�ӦʽΪ2CH3OH��3O2��4KOH===2K2CO3��6H2O������˵����ȷ����
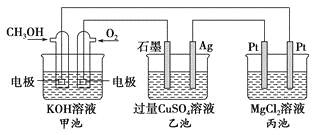
A. �׳��ǵ���ת��Ϊ��ѧ�ܵ�װ�ã��ҡ������ǻ�ѧ��ת�����ܵ�װ��
B. �׳�ͨ��CH3OH�ĵ缫��ӦʽΪCH3OH��6e����2H2O===CO32����8H��
C. ��Ӧһ��ʱ������ҳ��м���һ����Cu(OH)2������ʹCuSO4��Һ�ָ���ԭŨ��
D. �׳�������280 mL(��״����)O2����ʱ������������������1.45 g����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��������������ȷ����(����)
A. NO2����ˮ�������ᣬ����NO2������������
B. ���������ý�����Ӧ�����κ�����
C. ����������Ũ���ᷴӦ�����������ĺ���ɫ����
D. ������ͭ�ķ�Ӧ�ȱ��ֳ��������ֱ��ֳ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ��������С�������е����ֶ�����Ԫ��X��Y��Z��W����Ԫ�ص�ԭ������֮��Ϊ32�������ڱ���X��ԭ�Ӱ뾶��С��Ԫ�أ�Y��Z�������ڣ�Z��Wλ��ͬ���塣MԪ����Xͬ���壬��Wͬ���ڡ�
(1)Z��M��W����Ԫ�����Ӱ뾶�ɴ�С��˳����____(����Ӧ�����ӷ���)��
(2)�õ���ʽ��ʾM2W���γɹ���___________
(3)��M��Z��Ԫ���γɵ�ԭ�Ӹ�����Ϊ1��1������Ļ�ѧ��������______
(4)��X��Y��Z��W����Ԫ����ɵ�һ����A����֪����1molA��������NaOHŨ��Һ��Ӧ���ɱ�״����22.4L���塣��A�������ᷴӦ��������B��������������ˮ��Ӧ��д��A�Ļ�ѧʽ____��������B����ˮ��Ӧ�����ӷ���ʽ ____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com