
【题目】下列电离方程式正确的是( )
A. Ba(OH)2=Ba2++OH- B. Al2(SO4)3=2Al3++3SO42-
C. H2SO4=H2++SO42- D. NaHCO3=Na++H++CO32-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20 mL0.1 mol L-1 Na2CO3溶液中逐滴加入0.1 mol L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量浓度的百分含量随溶液pH变化的情况如下图所示。下列说法正确的是( )
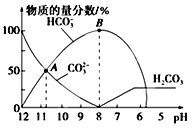
A. A点所处的溶液中c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
B. 随着盐酸的加入,溶液中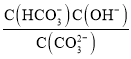 将减小
将减小
C. 随着盐酸的加入,当pH约为6时,溶液中开始放出气体
D. 当溶液的pH为7时,溶液的总体积为40mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子可以大量共存且溶液是无色的离子组是
A.H+、Na+、NO3-、Cu2+ B.Ba2+、Mg2+、Cl-、SO42-
C.NO3-、SO42-、K+、Mg2+ D.Mg2+、K+、OH-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
①Zn为正极,Cu为负极
②H+向负极移动
③Cu极有H2产生
④电子流动方向Zn→Cu
⑤正极的电极反应式是Zn-2e-=Zn2+
⑥若有1mol电子流过导线,则理论上产生0.5 mol H2
(1)卡片中记录合理的是___________(填序号)
(2)该电池总反应的离子方程式是___________________________
(3)若将稀硫酸换成硫酸铜溶液,电极质量增加的是_____________ (填“锌极”或“铜极”)
Ⅱ.某温度时,在2 L密闭容器中,三种气态物质X、 Y、Z的物质的量(n)随时间(t)变化的曲线如右图所示,可得:
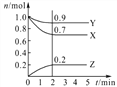
(1)该反应的化学方程式为_____________________
(2)反应开始至2 min,用Y表示的平均反应速率 为_______________
(3)在一定温度下,上述反应达到反应限度的标志的是____________
A. X、Y、Z的浓度相等
B. X、Y、Z的分子数比为3︰1︰2
C. Z的生成速率是Y的生成速率的二倍
D.单位时间内生成n mol Y,同时生成3n mol X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新装修房屋会释放有毒的甲醛(HCHO)气体,银-Ferrozine法检测甲醛的原理如下:

下列说法正确的是
A. 22.4LCO2中含共价键数目为4NA
B. 30gHCHO被氧化时转移电子数目为2 NA
C. 该电池总反应的化学方程式为2Ag2O+HCHO=4Ag+CO2↑+H2O
D. 理论上,消耗HCHO和消耗Fe3+的物质的量之比4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素性质呈周期性变化的根本原因是( )
A. 元素质量数的递增 B. 元素的原子半径呈周期性变化
C. 金属性和非金属性呈周期性变化 D. 原子核外电子排布呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.A~D是四种烃分子的球棍模型(如图)

(1)与A互为同系物的是___________(填序号)
(2)能使酸性高锰酸钾溶液褪色的物质是_____________(填序号)
(3)D和液溴反应的化学方程式是___________________________
Ⅱ.某些有机物的转化如下图所示。已知:A是营养物质之一,米饭、馒头中富含A,在酸性条件下水解的最终产物是B。C是白酒的主要成分,能直接氧化成酸性物质D。
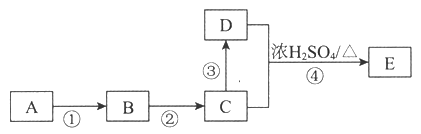
请回答下列问题:
(1)A的名称是_____________;C中官能团的名称是__________
(2)反应③所需要的试剂是__________________
(3)反应④的化学方程式是__________________________
(4)若实验室利用下图制备E,导管口不能深入N试管中液面下的原因是_______________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表揭示了许多元素的相似性和递变规律,下表中所示的一些元素。

(1)写出⑥元素的离子的核外电子排布示意图____________________。
(2)给④⑤⑥⑦⑧形成的单核离子的半径从大到小排序:_________(写离子符号)。
(3)给①②③④⑤⑥⑦⑧⑨的原子半径从大到小排序:__________(写原子符号)。
(4)给②⑥⑨最高价氧化物对应水化物碱性从大到小排序__________(写化学式)。
(5)给③④⑤的非金属性从大到小排序_________(写元素符号)。
(6)③是一种用途十分广泛的非金属,请写出③的最高价氧化物与过量的⑨的氢氧化物反应的化学方程式___________________________________。
(7)⑦号元素的氢氧化物有特殊的化学性质,写出⑦号元素的氯化物与足量的⑥号元素的氢氧化物反应的离子方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化铝(AlON)属原子晶体,是一种超强透明材料,下列描述错误的是
A. AlON和石英的化学键类型相同 B. AlON和石英晶体类型相同
C. AlON和Al2O3的化学键类型不同 D. AlON和Al2O3晶体类型相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com