
【题目】以天然气为原料合成尿素的生产中,主要反应之一为:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH>0,请根据题目要求回答下列问题:
CO(g)+3H2(g) ΔH>0,请根据题目要求回答下列问题:
(1)在一定条件下,将0.05 mol CH4和0.10 mol H2O(g)放入容积为2 L的密闭容器中,20 s时有0.01 mol CO生成,则H2的化学反应速率为。
(2)在其他条件不变的情况下降低温度,则逆反应速率(填“增大”“减小”或“不变”,下同);在其他条件不变的情况下增加压强,则正反应速率。
科目:高中化学 来源: 题型:
【题目】某温度下,密闭容器中发生反应aX(g) ![]() bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是( )
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是( )
A.可逆反应的化学方程式的化学计量数:a>b+c
B.压缩容器的容积时,v(正)增大,v(逆)减小
C.达到新平衡时,物质X的转化率减小
D.达到新平衡时,混合物中Z的质量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 电解法精炼铜时,以粗铜作阴极,纯铜作阳极
B. 反应NH3(g)+HCl(g)===NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
C. CH3COOH溶液加水稀释后,溶液中![]() 的值减小
的值减小
D. Na2CO3溶液中加入少量Ca(OH)2固体,CO![]() 水解程度减小,溶液的pH减小
水解程度减小,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同的载体(钛片、铝片、陶瓷)表面制备TiO2薄膜,探究不同载体下TiO2薄膜光催化使甲基橙脱色的效果,每光照20 min取一次样,实验结果如图所示。下列说法正确的是( )
A.不同载体,无论何种温度一定是钛片载体的光催化活性最好
B.约在520 ℃时,钛片载体的光催化活性最好
C.无论何种载体,催化活性总是随温度的升高而升高
D.不同载体,TiO2薄膜的光催化活性相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素中只有E为金属元素,五种元素的原子序数按B、D、C、A、E的顺序依次增大,D、C元素在周期表中位置相邻,在一定条件下,B的单质可以分别和A、C、D的单质化合生成甲、乙、丙化合物,C的单质和D的单质化合可得丁,戊、己、庚均为化合物。已知乙、丙每个分子中均含有10个电子,下图为相互转化关系:
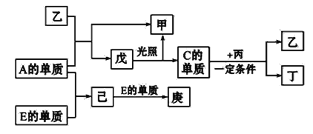
请回答下列问题:
(1)A在元素周期表中的位置:__________ ,写出实验室制取A的单质的离子反应方程式____________。
(2)戊的分子式为________。B与D形成的原子个数比为2∶1的化合物中,D原子最外层为8电子结构,请写出该化合物的电子式________________。
(3)C的单质与丙反应的化学方程式为______________________________。
(4)F为短周期元素,与C同主族,向己的溶液中通入FC2气体,发生反应的离子反应方程式为:_________________________________________ 。
(5)氟元素的非金属性比D元素强,用原子结构的知识解释__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于卤族元素由上到下性质递变规律的叙述,正确的是( )
①单质的氧化性减弱 ②单质的颜色加深 ③气态氢化物的稳定性增强
A.①②B.①②③C.②③D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是。
(2)实验①和②的目的是。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是。
(3)写出实验③的化学反应方程式:。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 己知化合物N是一种对氨基苯甲酸酯类物质,可作局部麻醉药。合成N的一种路线如下图:

已知以下信息:
①核磁共振氢谱显示B只有一种化学环境的氢,H苯环上有两种化学环境的氢;
②
③E为芳香烃,其相对分子质量为92;
④![]() (苯胺,易被氧化)。
(苯胺,易被氧化)。
回答下列问题:
(1)A的化学名称是_______________,检验B中官能团的试剂是____________,N中官能团的名称是_________________。
(2)由E生成F的化学方程式为____________________________。
(3)由F生成G的反应类型为______________,H在一定条件下可以发生聚合反应,写出该聚合反应的化学方程式:_______________________。
(4)D的同分异构体中不能与金属钠反应生成氢气的共有________种(不考虑立体异构)。
(5)参照上述合成路线,以乙烯、干醚和环氧乙烷为原料(无机试剂任选)制备1,6-已二醛,设计合成路线:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com