
【题目】A、B、C、D、E五种元素中只有E为金属元素,五种元素的原子序数按B、D、C、A、E的顺序依次增大,D、C元素在周期表中位置相邻,在一定条件下,B的单质可以分别和A、C、D的单质化合生成甲、乙、丙化合物,C的单质和D的单质化合可得丁,戊、己、庚均为化合物。已知乙、丙每个分子中均含有10个电子,下图为相互转化关系:
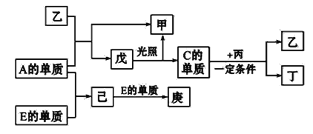
请回答下列问题:
(1)A在元素周期表中的位置:__________ ,写出实验室制取A的单质的离子反应方程式____________。
(2)戊的分子式为________。B与D形成的原子个数比为2∶1的化合物中,D原子最外层为8电子结构,请写出该化合物的电子式________________。
(3)C的单质与丙反应的化学方程式为______________________________。
(4)F为短周期元素,与C同主族,向己的溶液中通入FC2气体,发生反应的离子反应方程式为:_________________________________________ 。
(5)氟元素的非金属性比D元素强,用原子结构的知识解释__________________________。
【答案】第三周期第ⅦA族MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2OHClO
Mn2++Cl2↑+2H2OHClO![]() 4NH3+5O2
4NH3+5O2 ![]() 4NO+6H2O2Fe3++SO2+2H2O=2Fe2++SO42-+4H+F原子与N原子核外电子层数相同,但F元素的核电荷数比N元素的大,F的原子半径比N原子的小,F元素得电子能力比N元素强,所以氟元素的非金属性比N元素的强。
4NO+6H2O2Fe3++SO2+2H2O=2Fe2++SO42-+4H+F原子与N原子核外电子层数相同,但F元素的核电荷数比N元素的大,F的原子半径比N原子的小,F元素得电子能力比N元素强,所以氟元素的非金属性比N元素的强。
【解析】
这五种元素没有限定为短周期元素,由此可判断应该含有过渡元素,结合转化关系可知,E具有可变价态,即原子序数最大的金属元素E可能是Fe元素;B的原子序数最小,且与A、C、D反应分别生成甲、乙、丙化合物,其中乙、丙为10电子分子,可能是NH3和H2O,又C、D两元素相邻,所以B为H元素,C可能为O元素,D可能为N元素;A的单质与水反应生成一种光照可分解的物质(可能是HClO),可判断A可能为Cl元素,再结合转化关系进行全面推导,确定以上都是正确的。
(1)A是原子序数为17的Cl元素,在周期表的位置是第三周期第ⅦA族;实验室制取Cl2的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)氯气与水(乙)反应生成HCl(甲)和HClO (戊),所以戊的分子式为HClO;H和N形成的原子个数比为2∶1的化合物即N2H4,其电子式为![]() ;
;
(3)O2与NH3反应的化学方程式为4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
(4)F是与C同主族的短周期元素,即S元素,Cl2与铁化合生成己为FeCl3,将SO2通入FeCl3溶液中,发生反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(5)F与N两元素的原子核外电子层数相同,但F元素的核电荷数比N元素的大,F的原子半径比N原子的小,F元素得电子能力比N元素的强,所以氟元素的非金属性比N元素强。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:H2(g)+I2(g) ![]() 2HI(g) △H<0。达到平衡后,改变下列条件,反应速率将如何改变 (填“增大”“减小”或“不变”)?平衡将如何移动(填“向左”“向右”或“不变”)?
2HI(g) △H<0。达到平衡后,改变下列条件,反应速率将如何改变 (填“增大”“减小”或“不变”)?平衡将如何移动(填“向左”“向右”或“不变”)?
(1)升高温度,反应速率将 , 平衡将如何移动;
(2)加入正催化剂,反应速率将 , 平衡将如何移动;
(3)充入更多的H2 , 反应速率将 , 平衡将如何移动;
(4)扩大容器的体积,反应速率将 , 平衡将如何移动;
(5)容器体积不变,通入氖气,反应速率将 , 平衡将如何移动;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是

A. 离O点越远的元素原子半径越大 B. 虚线相连的元素处于同一族
C. B元素是图中金属性最强的元素 D. A、B组成的化合物中可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中化学键的类型相同的是( )
A.HCl、MgCl2、NH4ClB.NH3、H2O、CO2
C.N2、Na2O、CS2D.CaCl2、NaOH、H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以天然气为原料合成尿素的生产中,主要反应之一为:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH>0,请根据题目要求回答下列问题:
CO(g)+3H2(g) ΔH>0,请根据题目要求回答下列问题:
(1)在一定条件下,将0.05 mol CH4和0.10 mol H2O(g)放入容积为2 L的密闭容器中,20 s时有0.01 mol CO生成,则H2的化学反应速率为。
(2)在其他条件不变的情况下降低温度,则逆反应速率(填“增大”“减小”或“不变”,下同);在其他条件不变的情况下增加压强,则正反应速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NH4HCO3在试管中加热,使放出的气体依次通过盛有足量过氧化钠的干燥管、足量浓硫酸的洗气瓶,最后得到的气体是( )
A.NH3
B.H2O
C.O2
D.CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X是中学化学常见化合物或单质,均由短周期元素组成,转化关系如图。请据图回答下列问题:

(1)若A、B、C中均含同一种常见金属元素R,R在C中以阴离子形式存在,B为白色胶状沉淀。
①R在元素周期表中的位置为______________。
②若A的溶液中混有Fe3+,当向该混合液中加入氨水,生成R(OH)n及Fe(OH)3共沉淀时,溶液中c(Fe3+)/ c(Rn+)=____。[已知:Fe(OH)3的 Ksp=4.00×10-38,沉淀B的Ksp=1.32×10-33 ]
(2)若A、B、C的焰色反应均为黄色,水溶液均呈碱性。
①A中含有的化学键是________________________。
②将672 mL(标准状况下)X通入100 mL 0.4mol·L- 1 A的溶液后,溶液中离子浓度由大到小的顺序为_______________________。
③自然界中存在B、C和H2O按一定比例形成的固体。取一定量该固体制成100mL溶液,测得溶液中金属阳离子的浓度为0.5mol·L-1。若取相同质量的固体加热至恒重,剩余固体的质量为_______。
(3)若A、B、C中均含同一种常见非金属元素,其中A为黑色固体单质。已知298K下,1mol A、1 mol B完全燃烧生成稳定氧化物放出的热量分别为393.5 kJ,283 kJ。写出该温度下A与C反应生成B的热化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,标准状况下某O2和N2的混合气体mg含有b个分子,则ng该混合气体在相同状况下所占的体积应是( )
A.![]() L
L
B.![]()
C.![]()
D.![]() L
L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com