
【题目】将NH4HCO3在试管中加热,使放出的气体依次通过盛有足量过氧化钠的干燥管、足量浓硫酸的洗气瓶,最后得到的气体是( )
A.NH3
B.H2O
C.O2
D.CO2
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于食物的酸碱性说法,错误的是( )
A.柠檬吃起来是酸的,故它属于酸性食物
B.正常人体内各体液的pH总保持一定范围
C.通常富含蛋白质、脂肪和糖类的食物多为酸性食物
D.食物的酸碱性与化学上所指溶液的酸碱性是不同的概念
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关描述正确的是( )
A.钠在空气中燃烧,发出淡蓝色的火焰,生成淡黄色固体
B.硅能导电,可用作光导纤维
C.玻璃花瓶和餐桌上的瓷盘都是硅酸盐产品
D.久置的氯水与新制的氯水,都能使有色布条褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素中只有E为金属元素,五种元素的原子序数按B、D、C、A、E的顺序依次增大,D、C元素在周期表中位置相邻,在一定条件下,B的单质可以分别和A、C、D的单质化合生成甲、乙、丙化合物,C的单质和D的单质化合可得丁,戊、己、庚均为化合物。已知乙、丙每个分子中均含有10个电子,下图为相互转化关系:
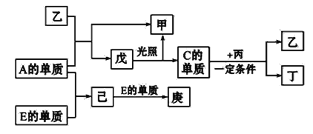
请回答下列问题:
(1)A在元素周期表中的位置:__________ ,写出实验室制取A的单质的离子反应方程式____________。
(2)戊的分子式为________。B与D形成的原子个数比为2∶1的化合物中,D原子最外层为8电子结构,请写出该化合物的电子式________________。
(3)C的单质与丙反应的化学方程式为______________________________。
(4)F为短周期元素,与C同主族,向己的溶液中通入FC2气体,发生反应的离子反应方程式为:_________________________________________ 。
(5)氟元素的非金属性比D元素强,用原子结构的知识解释__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化氮、二氧化氮等氮氧化物是常见的大气污染物,然而它们在工业上有着广泛的用途。
已知:①室温下,2NO+Na2O2===2NaNO2;
②酸性条件下,NO或NO2-都能与MnO反应生成NO3-和Mn2+,如5NO2-+2MnO4-+6H+===5NO3-+2Mn2++3H2O。
Ⅰ.以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示:

(1)A中观察到的现象是_________________________________。
(2)B中反应的离子方程式是____________________,_______________________。
(3)装置C的作用是___________________,装置F的作用是__________________。
(4)若无装置D,则E中产物除亚硝酸钠外,还有副产物________(填化学式)。
Ⅱ.某研究性学习小组对NO2与Na2O2能否发生反应进行探究。
(提出假设)
假设一:NO2与Na2O2不反应;
假设二:NO2能被Na2O2氧化;
假设三:______________________________________________。
(设计实验)
(1)实验时,将NO2气体通入盛有Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明假设________不成立。
(2)若假设二成立,则反应的化学方程式是_______________________。
(3)为验证假设二是否成立,该小组同学进行如下定性实验研究,请完成下表内容。
实验步骤(不要求写具体操作过程,试剂、仪器任选) | 预期的实验现象及结论 |
取适量的白色固体置于试管中,加蒸馏水溶解,_________________________ | _______________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是。
(2)实验①和②的目的是。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是。
(3)写出实验③的化学反应方程式:。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据以下信息回答有关问题:
I.NOx是汽车尾气的主要污染物之一。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:

该反应的△H=________________________。
(2)科学家通过实验发现,在紫外线照射下TiO2会使空气中的某些分子产生活性基团OH,并且活性基团OH可与NO2、NO发生反应生成硝酸和水。根据左下图示,请写出OH与NO反应的化学方程式______________________________________。

(3)电解法可将工业废气中含有的NO2消除。原理是先将NO2转化为N2O4,然后电解得到N2O5 (常温下为无色固体,常做绿色硝化剂)。电解原理如右上图所示,该电解池中生成N2O5的电极反应式是___________。
Ⅱ为研究哈伯法合成氨反应,T℃时,在容积为2 L恒容容器中通入4 mol N2和12mol H2,反应如下:N2(g)+3H2(g) ![]() 2NH3(g),若25min时反应达到平衡,各物质浓度随时间变化曲线如下图中甲、乙、丙。回答下列问题:
2NH3(g),若25min时反应达到平衡,各物质浓度随时间变化曲线如下图中甲、乙、丙。回答下列问题:

(1)0-25min内,反应的平均速率v(H2)为_________。
(2)T℃时,该反应的平衡常数K=_____________ (用最简分数表达)。
(3)T℃时,若起始充入8mol N2和24 mol H2,则反应刚达到平衡时,表示c( H2)在右图中相应的点为_____(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,HNO2的电离平衡常数为K=4.6×10﹣4(已知 ![]() =2.14),向20mL0.01molL﹣1的HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是( )
=2.14),向20mL0.01molL﹣1的HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是( ) 
A.HNO2的电离方程式为HNO2=NO2﹣+H+
B.a点H2O电离出的c(H+)=2.14×10﹣3molL﹣1
C.b点溶液中离子浓度大小关系为c(NO2﹣)>c(Na+)>c(H+)>c(OH﹣)
D.X值等于20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氮的固定是几百年来科学家一直研究的课题 。
下表列举了不冋温度下大气固氮和工业固氮的部分化学平衡常数K的值:
反应 | 大气固氮N2(g)+O2(g) | 工业固氮N2(g)+3H2 (g) | |||
温度/℃ | 27 | 2000℃ | 25 | 400 | 450 |
K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 200 |
①分析数据可知:大气固氮反应属于_____________ (填“吸热”或“放热”反应。
②从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因________________________________。
③在一定的温度和压强下,把2体积N2和6体积H2充入一容积可变的密闭容器中,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0。反应达到平衡后N2的质量分数为a%,若在相同容器中充入m 摩尔的N2和n 摩尔的H2也能使平衡时N2的质量分数达到a%,则m 和n 的关系用代数式表达应为___________。若在一定温度下的定容密闭容器中发生上述反应,能说明此反应已达化学平衡状态的是________。
2NH3(g) △H<0。反应达到平衡后N2的质量分数为a%,若在相同容器中充入m 摩尔的N2和n 摩尔的H2也能使平衡时N2的质量分数达到a%,则m 和n 的关系用代数式表达应为___________。若在一定温度下的定容密闭容器中发生上述反应,能说明此反应已达化学平衡状态的是________。
A.密度不变 B.混合气体平均相对分子质量不变
C.V正(N2)= 2v逆(NH3) D.N2的体积分数不再改变
(2)体积均为10mL,pH均为2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH 变化如图:则HX 的电离平衡常数_________(填“大于”、“等于”或“小于”)醋酸的电离平衡常数。稀释后,HX溶液中水电离出来的c (H+)_______ (填“大于”、“等于”或“小于”)醋酸的溶液中水电离出来的c (H+),理由是_______________________________________。

(3)已知100℃时,水的离子积常数为1×10-12,将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a∶b=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com