
����Ŀ�������£�HNO2�ĵ���ƽ�ⳣ��ΪK=4.6��10��4����֪ ![]() =2.14������20mL0.01molL��1��HNO2��Һ����μ�����ͬŨ�ȵ�NaOH��Һ����û��Һ��pH��NaOH��Һ����ı仯��ͼ��ʾ�������ж���ȷ���ǣ�������
=2.14������20mL0.01molL��1��HNO2��Һ����μ�����ͬŨ�ȵ�NaOH��Һ����û��Һ��pH��NaOH��Һ����ı仯��ͼ��ʾ�������ж���ȷ���ǣ������� 
A.HNO2�ĵ��뷽��ʽΪHNO2=NO2��+H+
B.a��H2O�������c��H+��=2.14��10��3molL��1
C.b����Һ������Ũ�ȴ�С��ϵΪc��NO2������c��Na+����c��H+����c��OH����
D.Xֵ����20
���𰸡�C
���������⣺A��HNO2�ĵ���ƽ�ⳣ��ΪK=4.6��10��4��������Ϊ������ڵ���ƽ�⣬���뷽��ʽΪHNO2NO2��+H+����A����
B����HNO2H++NO2����K= ![]() ��
�� ![]() ��4.6��10��4��
��4.6��10��4�� ![]() ���õ�c��H+��=2.14��10��3mol/L��ˮ�����������Ũ��ԶС�������������ӣ���B����
���õ�c��H+��=2.14��10��3mol/L��ˮ�����������Ũ��ԶС�������������ӣ���B����
C��b����ҺΪHNO2��NaNO2�����Һ����Ũ�ȱ�Ϊ1��1����NO2��+H2OHNO2+OH����HNO2H++NO2��������̶ȴ���ˮ��̶ȣ���֪��Һ�����ԣ�����Ũ�ȴ�СΪc��NO2������c��Na+����c��H+����c��OH��������C��ȷ��
D����20mL0.01molL��1��HNO2��Һ����μ�����ͬŨ�ȵ�NaOH��Һ����ǡ�÷�Ӧ��Ҫ����������Һ���20��ml��C������Һ�����ԣ�����ΪHNO2��NaNO2�����Һ��X��20ml����D����
��ѡC��
�����㾫�������ڱ��⿼������������ˮ��Һ�еĵ���ƽ�⣬��Ҫ�˽������ʷ����������ӵ����ʵ��ڽ�ϳɷ��ӵ�����ʱ��������ʵĵ���ʹ��ڵ���ƽ��״̬������ƽ���ǻ�ѧƽ���һ�֣�ͬ�����л�ѧƽ��������������ı�ʱƽ���ƶ��Ĺ��ɷ�����ɳ����ԭ�����ܵó���ȷ�𰸣�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��ͨ����ͼװ��ʵ�飬̽��SO2��Na2O2��Ӧ�IJ�� 
��1�����鷴Ӧ���Ƿ���O2���ɵķ�����������O2���ɣ���д��װ��C�еĻ�ѧ����ʽ �� ��A��ʢװH2SO4��Һ��������������Dװ�ó����˷�ֹ�����е�ˮ�����Ͷ�����̼����Cװ����Na2O2��Ӧ�����⣬������ ��
��2����C�й���������ֻ��Na2SO3��ֻ����Na2SO3��Na2SO4���ֶ��У� ����Na2O2��Ӧ��ȫ��Ϊȷ��C�й������ijɷ֣���ͬѧ������£�����������ѡ�Լ���������������ɸ�̽�����̣�������д�ڴ����Ӧλ�ã�
��ѡ�Լ���������0.1mol/LKMnO4������Һ��0.01mol/LKMnO4������Һ��0.1mol/LBa��NO3��2��Һ��0.1mol/LBaCl2��Һ��1mol/L HNO3��Һ��1mol/L���ᡢ�Թܡ���ͷ�ιܣ�
ʵ����� | Ԥ������ͽ��� |
����һ��ȡ����C�й���������Թ��У���������������ˮ�������ܽ⣬�ֱ�ȡ������A��B�Թ��У� | ������ȫ�ܽ⣬�õ���ɫ����Һ |
�������ȡ�Թ�A������Һ�м��� �� ���۲���Һ��ɫ�仯�� | ���� |
��������ȡ�Թ�B���������ȼ��� �� ���ټ��� �� �� | ���� �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ˮ�Ĺ����У� ��
A.ֻ�ƻ����Ӽ�B.���ƻ����Ӽ���Ҳ�ƻ����ۼ�
C.ֻ�ƻ����ۼ�D.���ƻ����Ӽ���Ҳ�ƻ����Ӽ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ������������ǣ�������
A.
�ɱ�ʾ��SO2����ͨ����ˮʱpH�ı仯
B.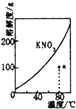
��ʾKNO3���ܽ�����ߣ�a����80���KNO3�IJ�������Һ
C.
��ʾ������Һ��ͨ�백����������������Һ�����Եı仯
D.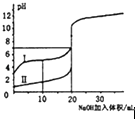
��ʾ�����£�0.100mol/L NaOH��Һ�ֱ�ζ�0.100mol/L������ʹ���ĵζ����ߣ���ͼ֪IΪ����ĵζ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������з�Ӧ�ϳ������谷��CaO+3C ![]() CaC2+CO��CaC2+N2
CaC2+CO��CaC2+N2 ![]() CaCN2+C��CaCN2+2H2O�TNH2CN+Ca��OH��2 �� NH2CN��ˮ��Ӧ��������[CO��NH2��2]�����ؿɽ�һ���ϳ������谷��
CaCN2+C��CaCN2+2H2O�TNH2CN+Ca��OH��2 �� NH2CN��ˮ��Ӧ��������[CO��NH2��2]�����ؿɽ�һ���ϳ������谷��
��1��CaCN2��������ΪCN22�� �� ��CN22����Ϊ�ȵ�����ķ�����N2O�����ѧʽ�����ɴ˿�����֪CN22���Ŀռ乹��Ϊ ��
��2�������谷�� 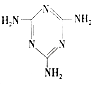 ���׳ơ����������������������谷���������ᣨ
���׳ơ����������������������谷���������ᣨ 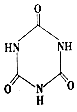 �� �����������������谷�����֮��ͨ����ϣ������������γɽ�ʯ��
�� �����������������谷�����֮��ͨ����ϣ������������γɽ�ʯ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1���ij��̬����2����Ȼ��ⷢ���ӳɷ�Ӧ�����ܺ�6�����������ȡ����Ӧ���ɴ˿��Զ϶�ԭ��̬���ǣ��������������ͬ�����²ⶨ���� ��
A.��Ȳ
B.��Ȳ
C.��Ȳ
D.����ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʴ�ŷ���������ǣ� ��
A.��Ƭ���ڷ����ڲ��ܷ��ֽ����B.�ռ�ڷ������ձ���
C.�����ܷ����Լ�ƿ��D.���״������ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�0.1mol��L-1��H2A��Һ�и�����Ũ�ȵĶ���ֵ(lgc)��pH�Ĺ�ϵ��ͼ��ʾ��( )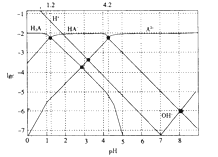
����˵������ȷ����
A.H2A�Ƕ�Ԫ����
B.HA-![]() H++A2-�ĵ���ƽ�ⳣ��Ka=10-12
H++A2-�ĵ���ƽ�ⳣ��Ka=10-12
C.0.1mol��L-1��H2A��Һ�У�c(H+)=c(HA-)+2c(A2-)+c(OH-)
D.pH=4.2 ʱ��c(HA-)=c(A2-)>c(H+)>c(H2A)>c(OH-��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�ý�������ʵ�飬�ܵ�����Ӧʵ����۵��� ( )
ѡ�� | �� | �� | �� | ʵ����� |
|
A | Ũ���� | Na2SO3 | KMnO4��Һ��ɫ | SO2��Ư���� | |
B | Ũ���� | KMnO4 | FeBr2��Һ��Ϊ��ɫ | �����ԣ�Cl2 >Br2 | |
C | ϡ���� | ̼���� | CaCl2��Һ�����Ա仯 | CO2����CaCl2��Ӧ | |
D | Ũ���� | ���� | ��ˮ��ɫ | Ũ���������ˮ�ԡ���ˮ�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com