
【题目】在一定温度下,容器内某一容器中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是
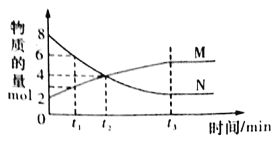
A.反应的化学方程式为:2M![]() N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】【化学——选修2:化学与技术】
某工厂用软锰矿(含MnO2约70% 及A12O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2和Zn(干电池原料)。

已知:①A是![]() 的混合液。
的混合液。
②IV中的电解方程式为:![]()
(l)A中属于还原产物的是________________________。
(2)加人MnCO3、Zn2(OH)2CO3的作用 ________________________。
II需要加热的原因是:____________________。C的化学式是 _______________。
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是_________________。
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是_____________。
(5)要从Na2SO4溶液中得到芒硝(Na2SO4·10H2O),需进行的操作有蒸发浓缩、___________、过滤、洗涤、干燥等。
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制240mL 0.4molL﹣1的Na2CO3溶液,试回答下列问题:
(1)选择仪器:完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、 、 等.
(2)计算:需要Na2CO3固体的质量为 .
(3)称量:称量过程中Na2CO3固体应放于小烧杯中并放在天平的 (填“左盘”或“右盘”).
(4)转移、洗涤.在转移时应使用 引流,洗涤烧杯2~3次是为了 .
(5)定容、摇匀.定容的操作是 .
(6)某学生实际配制Na2CO3溶液的浓度为0.39molL﹣1,原因可能是 (填字母).
A.使用滤纸称量Na2CO3固体
B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】仅用下表提供的仪器(夹持仪器和试剂任选)不能实现相应实验目的的是( )
选项 | 实验目的 | 仪 器 |
A | 除去氢氧化铝胶体中的泥沙 | 漏斗(带滤纸)、烧杯、玻璃棒 |
B | 从食盐水中获得NaCl晶体 | 坩埚、玻璃棒、酒精灯、泥三角 |
C | 用0.10 mol·L-1的盐酸测定未知浓度的NaOH溶液浓度 | 碱式滴定管、酸式滴定管、锥形瓶、胶头滴管、烧杯 |
D | 用MnO2和浓盐酸制取干燥、纯净的Cl2 | 圆底烧瓶、分液漏斗、酒精灯、洗气瓶、集气瓶、导管、石棉网 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把200mL含有BaCl2和KCl的混合溶液分成2等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀,另取一份加入含b mol硝酸银的溶液恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
A.0.1(b﹣2a) molL﹣1
B.10(2a﹣b) molL﹣1
C.10(b﹣a) molL﹣1
D.10(b﹣2a) molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是

A.HA为强酸
B.该混合液pH=7
C.图中X表示HA,Y表示OH-,Z表示H+
D.该混合溶液中:c(A-)+c(Y)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与实验相关的叙述正确的是
A. 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中
B. 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出
C. 盛放NaOH溶液时,使用带玻璃瓶塞的磨口瓶
D. 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入稀盐酸和BaCl2溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com