
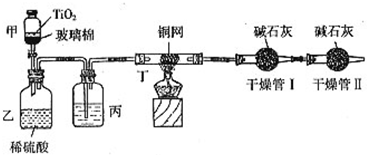
 (2010?陕西模拟)根据环保要求,在处理有氰电镀废水时,剧毒的CN-在催化剂TiO2颗粒作用下,先用NaClO将CN-氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2.环保工作人员在密闭系统中用下图装置进行实验,测定CN-被处理的百分率.
(2010?陕西模拟)根据环保要求,在处理有氰电镀废水时,剧毒的CN-在催化剂TiO2颗粒作用下,先用NaClO将CN-氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2.环保工作人员在密闭系统中用下图装置进行实验,测定CN-被处理的百分率.| 1.408g |
| 44g/mol |
| 0.032mol |
| 0.04mol |


 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:
| 阳离子 | K+ Na+ Cu2+Al3+ |
| 阴离子 | SO42-HCO3-NO3- OH- |
 Al(OH)3+3H+
Al(OH)3+3H+ Al(OH)3+3H+
Al(OH)3+3H+查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com