
| A、CO32-、OH-、Na+、H+ |
| B、Al3+、Na+、AlO2-、Cl- |
| C、Ba2+、HCO3-、K+、SO42- |
| D、S2-、H+、SO42-、Cu2+ |


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
| A、分子式为C8H10的芳香烃,其一氯代物的种类不可能为1种 |
| B、天然橡胶的主要成分是异戊二烯,工业生产使之发生加聚反应才能使用 |
| C、蔗糖酯是一种食品乳化剂,可以由蔗糖与脂肪酸经酯化反应合成,蔗糖酯在稀硫酸的作用下充分水解只生成两种产物 |
| D、按照系统命名法,化合物(CH3)3CCH2C(CH3)=CH2的名称为2,4,4-甲基-2-戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5mol?L-1 |
| B、1.0mol?L-1 |
| C、1.5mol?L-1 |
| D、2.0mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知氧化性:Au3+>Ag+>Cu2+>Pb2+>Cr3+>Zn2+>Ti2+.现有如图所示的电化学装置,下列叙述中正确的是( )
已知氧化性:Au3+>Ag+>Cu2+>Pb2+>Cr3+>Zn2+>Ti2+.现有如图所示的电化学装置,下列叙述中正确的是( )| A、若X为Ti,则Y极的电极反应式可能是Zn-2e-═Zn2+ |
| B、若X为Cr,则Y可以选Zn或Ti |
| C、若Y为Cu,则X极的电极反应式可能是Cr-3e-═Cr3+ |
| D、若Y为Pb,则Xn+(aq)中阴离子数会减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| CH4 | C2H4 | C3H8O | C5H10 | C6H14O | C7H16 | C8H16 | C9H20O |
| A、2 | B、3 | C、4 | D、5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
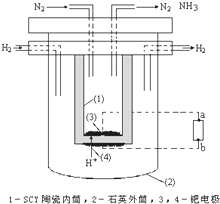 合成氨工业对国民经济和社会发展具有重要的意义.其原理为:
合成氨工业对国民经济和社会发展具有重要的意义.其原理为:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com