
【题目】某兴趣小组设计如图所示微型实验装置。实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1、闭合K2,发现电流表A指针偏转。下列有关描述正确的是( )

A. 断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl-![]() Cl2↑+H2↑
Cl2↑+H2↑
B. 断开K2,闭合K1时,石墨电极附近溶液变红
C. 断开K1,闭合K2时,铜电极上的电极反应式为:Cl2+2e-=2Cl-
D. 断开K1,闭合K2时,石墨电极作正极
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】X、Y、L、M为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、L与M三种元素的质子数均为5的倍数。回答下列问题:
(1)X与L组成的最简单化合物的电子式为____________。
(2)X与M组成的物质为_____________(填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式为__________。
(3)Y在周期表中的位置是____________,其含氧酸的化学式为______________。
(4)L与M形成的化合物中L的化合价是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由下列方法制得高效饮用水处理剂高铁酸钠(Na2FeO4):Fe2O3 + 3Na2O2 ![]() 2Na2FeO4 + Na2O,下列说法正确的是( )
2Na2FeO4 + Na2O,下列说法正确的是( )
A.反应中Fe2O3是还原剂
B.Fe2O3可以通过铁丝在氧气中燃烧制得
C.3molNa2O2反应,有3mol电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)又称保险粉,是印刷工业中重要的还原剂。某课题小组进行如下实验:
Ⅰ.查阅资料
①连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇。
②2Na2S2O4+4HCl===4NaCl+S↓+3SO2↑+2H2O;
Na2S2O3+2HCl===2NaCl+S↓+SO2↑+H2O。
Ⅱ.制备方法
75 ℃时将甲酸钠和纯碱加入乙醇溶液中,通入SO2进行反应,完成其反应的化学方程式:
________HCOONa+________Na2CO3+________===________Na2S2O4+________CO2+______
冷却至40~50 ℃,过滤,用________洗涤,干燥制得Na2S2O4。
Ⅲ.Na2S2O4的性质
(1)Na2S2O4溶液在空气中易被氧化。课题小组测定0.050 mol·L-1 Na2S2O4溶液在空气中pH变化如图所示:
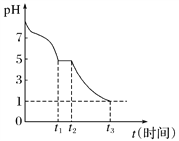
0~t1段主要生成HSO![]() ,根据pH变化图,HSO
,根据pH变化图,HSO![]() 的电离程度________(填“<”或“>”)水解程度。
的电离程度________(填“<”或“>”)水解程度。
0~t1段发生反应的离子方程式为_____________。
t3时溶液中存在的主要阴离子的符号是_________________。
(2)隔绝空气加热Na2S2O4固体完全分解;得到固体产物Na2SO3、Na2S2O3和________(填化学式)气体。
请你设计实验验证产物有Na2S2O3存在,完成下表中内容。
(供选择的试剂:稀盐酸、稀硝酸、BaCl2溶液、KMnO4溶液)
实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
______ | _________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据元素周期表及元素周期律,下列推断中正确的是
A. 同一周期元素的原子,半径越小越容易失去电子
B. ⅠA族元素的金属性比ⅡA族元素的金属性强
C. 向氢硫酸溶液中滴入氯水有单质硫生成,可以验证硫元素的非金属性比氯元素弱
D. 主族元素的最高正化合价等于该元素原子的核外电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有7 种物质,①甲烷②苯③2一丁炔④环己烷⑤邻二甲苯⑥环己烯⑦二氧化硫,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是( )
A. ③⑥⑦ B. ②④⑥⑦ C. ②⑤⑥⑦ D. ④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
A. HCO3-、NH4+、H+、Cl- B. Al3+、OH-、Na+、Cl-
C. Na+、 H+ 、Fe2+、NO3- D. Mg2+、Fe3+、NO3-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为易溶于水的化合物,其离子组成如下表。(各化合物中离子组成不重复)
阳离子 | Na+、Al3+、Ag+、Ba2+、Fe3+ |
阴离子 | Cl-、CO32-、SO42-、NO3-、OH- |
分别取溶液进行如下实验:
①用pH试纸分别测得B、C溶液均呈碱性,且0.1 molL B溶液pH>13;
②D溶液加入铜粉,溶液质量增加;
③在E溶液中逐滴滴入B至过量,先生成白色沉淀,后沉淀完全溶解;
④在A溶液中逐滴滴入氨水至过量,先生成白色沉淀,后沉淀完全溶解。
请回答下列问题:
(1)B的名称;_______________,E的名称;______________。
(2)C水溶液呈碱性原因:_____________(用离子方程式表示);0.1mol/L的C溶液中和0.1mol/L的NaHCO3溶液中,阴离子的总数:C溶液___________NaHCO3溶液。(填“>”或 “<”)
(3)D溶液呈________(填“酸性”“碱性”或“中性”)。若将D溶液加热蒸干得到固体应是__________(填化学式)。若将E溶液加热蒸干后再高温灼烧得到固体应是___________ (填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com