
【题目】过二硫酸钾(K2S2O8)在科研与工业上有重要用途。
(1)S2O82-的结构式为[![]() ]2-,其中S元素的化合价为_____。在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是_____(填离子符号)。
]2-,其中S元素的化合价为_____。在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是_____(填离子符号)。
(2)某厂采用湿法K2S2O8氧化脱硝和氨法脱硫工艺综合处理燃煤锅炉烟气,提高了烟气处理效率,处理液还可以作为城市植被绿化的肥料。
①脱硫过程中,当吸收液pH=6时,n(SO32-)﹕n(HSO3-)=____。[已知:25℃时,Ka1(H2SO3)=1.5×10-2;Ka2(H2SO3)=1.0×10-7]
②脱硝过程中依次发生两步反应:第1步K2S2O8将NO氧化成HNO2,第2步K2S2O8继续氧化HNO2,第2步反应的化学方程式为________________________________;一定条件下,NO去除率随温度变化的关系如图所示。80℃时,若NO初始浓度为450 mg·m-3,t min达到最大去除率,NO去除的平均反应速率:v(NO) =_______mol.L-1·min-1(列代数式)。

(3)过二硫酸钾可通过“电解→转化→提纯”方法制得,电解装置如下图所示。

①电解时,铁电极连接电源的______极。
②常温下,电解液中含硫微粒主要存在形式与pH的关系如下图所示。已知,硫酸的二级电离常数1.02×10-2,在阳极放电的离子主要是HSO4-,阳极区电解质溶液的pH范围为________,阳极的电极反应式为________。

③往电解产品中加入硫酸钾,使其转化为过二硫酸钾粗产品,提纯粗产品的方法是____________。
【答案】+6 MnO4- 1:10 HNO2+ K2S2O8+ H2O = HNO3 + K2SO4+ H2SO4 15×0.916×10-6/t(或13.74×10-6/t或450÷30×0.916×10-6/t) 负 [0,2] 2HSO4-–2e-= S2O82-+2H+ 重结晶
【解析】
(1)根据S2O82-的结构式判断S的化合价,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是MnO4-;
(2)①根据pH=6时,Ka2=c(SO32-)c(H+)/c(HSO3-)=1.0×10-7,计算n(SO32-)∶n(HSO3-)的比值;
②根据第2步,K2S2O8继续氧化HNO2,K2S2O8作氧化剂,还原成H2SO4写出化学方程式,根据速率的公式进行计算;
(3)①电解时,铁作阴极,铁电极连接电源的负极;
②阳极区电解质溶液的pH范围为0-2,根据S化合价不变,O由-2升高至-1价,失电子,写出阳极的电极反应式;
③依据两者的溶解度差异,提纯粗产品的方法用重结晶的方法。
(1)S2O82-的结构式为![]() ,每个硫与4个O原子形成6个共价键,其中S元素的化合价为+6;在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是MnO4-,故答案为:+6,MnO4-。
,每个硫与4个O原子形成6个共价键,其中S元素的化合价为+6;在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是MnO4-,故答案为:+6,MnO4-。
(2)①脱硫过程中,当氨吸收液的pH=6时,HSO3-SO32-+H+,Ka2=c(SO32-)c(H+)/c(HSO3-)=1.0×10-7,n(SO32-)∶n(HSO3-)=1:10,故答案为:1:10。
②脱硝过程中依次发生两步反应:第1步,K2S2O8将NO氧化成HNO2,第2步,K2S2O8继续氧化HNO2,K2S2O8作氧化剂,还原成H2SO4,第2步反应的化学方程式为HNO2+K2S2O8+H2O=HNO3+K2SO4+H2SO4;80℃时,若NO初始浓度为450mg·m-3,即450/30×10-6mol/L,tmin达到最大去除率为0.916,NO去除的平均反应速率:v(NO)= 450÷30×0.916×10-6/tmol·L-1·min-1,故答案为:HNO2+K2S2O8+H2O=HNO3+K2SO4+H2SO4;15×0.916×10-6/t(或13.74×10-6/t或450÷30×0.916×10-6/t)。
(3)①电解时,铁作阴极,铁电极连接电源的负极,故答案为:负极。
②常温下,在阳极放电的离子主要是HSO4-,电解HSO4-生成S2O82-,由图HSO4-存在的pH范围-2~2,S2O82-存在的pH范围0-2,阳极区电解质溶液的pH范围为0-2;S化合价不变,O由-2升高至-1价,失电子,阳极的电极反应式为2HSO4-–2e-=S2O82-+2H+;
故答案为:[0,2];2HSO4-–2e-=S2O82-+2H+。
③往电解产品中加入硫酸钾,使其转化为过二硫酸钾粗产品,依据两者的溶解度差异,提纯粗产品的方法用重结晶的方法,故答案为:重结晶。


科目:高中化学 来源: 题型:
【题目】碳正离子[例如,CH3+,CH5+,(CH3)3C+等]是有机反应中重要的中间体。欧拉(G.Olah)因在此领域研究中的卓越成就而荣获1994年诺贝尔化学奖。碳正离子CH5+可以通过CH4在“超强酸”中再获得一个H+而得到,而CH5+失去H2可得CH3+。
(1)CH3+ 是反应性很强的正离子,是缺电子的,其电子式是__________________。
(2)CH3+ 中4个原子是共平面的,三个键角相等,键角应是_________(填角度)。
(3)(CH3)2CH+ 在NaOH的水溶液中反应将得到电中性的有机分子,其结构简式是_____________。
(4)(CH3)3C+ 去掉H+ 后将生成电中性的有机分子,其结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物a(![]() )、b(
)、b(![]() )、c(
)、c(![]() )的说法正确的是
)的说法正确的是
A. a、b、c的分子式均为C8H8
B. a、b、c均能与溴水发生反应
C. a、b、c中只有a的所有原子会处于同一平面
D. a、b、c的一氯代物中,b有1种,a、c均有5种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸( H3BO3) 为一元弱酸,H3BO3可以通过电解的方法制备。其工作原理如右图所示( 阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法错误的是
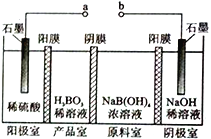
A. a 与电源的正极相连接
B. 阳极的电极反应式为:2H2O-4e-=O2↑+4H+
C. [B(OH)4]-穿过阴膜进入产品室,Na+穿过阳膜进入阴极室
D. 当电路中通过3mol 电子时,可得到1molH3BO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+XOH- =Fe3O4+S4O62-+2H2O,下列说法正确的是( )
A. 硫元素被氧化,铁元素被还原
B. Fe2+、S2O32- 都是还原剂
C. X=2
D. 每生成1mol Fe3O4,则转移电子数2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Na、Mg、Al分别与足量的盐酸反应,放出的氢气在相同条件下体积比为1:2:3,则Na、Mg、Al三种金属的物质的量之比为( )
A.1:1:1B.1:2:3C.1:1:2D.3:3:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是( )
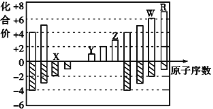
A. 气态氢化物的稳定性:R>W
B. X与Y可以形成原子个数比为1∶1和1∶2的两种离子化合物
C. 由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是X2-
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com