
下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | | | |||||
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | | ⑦ | | ⑧ | ⑨ |
| 4 | ⑩ | | | | | | | |
| 电离能I(eV) | A | B | C | D | E |
| I1 | 11.3 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 113.9 | 138.3 | 141.3 | 153.7 |
(1)CH4 NH3 H2O (任写两种)。
(2)N>O>C> Na (写元素符号)。
(3)HClO4 KOH电子式:
(4)Al2O3 Al2O3 +2OH- =2AlO 2-+H2O。
(5)A B; D的P轨道全空,能量更低更稳定。
解析试题分析:(1)①~⑩元素分别是H、C、N、O、Na、Al、P、Cl、Ar、K,由元素组成的分子中电子总数为10的分子有CH4 NH3 H2O HF等
(2)②、③、④、⑤元素分别是C、N、O、Na,根据电离能的递变规律,N最外层半充满,第一电离能最大,Na的电子层数最多,第一电离能最小,O、C位居其中,所以第一电离能的大小顺序为N>O>C > Na
(3)元素的非金属性越强,其最高价含氧酸的酸性越强,所以酸性最强是酸是氯元素对应的高氯酸,化学式为HClO4,金属性越强,其最高价氧化物的水化物的碱性越强,所以碱性最强的碱是KOH,其电子式为
(4)具有两性的最高价氧化物是Al2O3;其与氢氧化钠溶液反应的离子方程式:Al2O3 +2OH- =2AlO 2-+H2O
(5)非金属元素的第一电离能比较大,通过表中数据可以判断第一电离能较大的为非金属元素,AB可能属于非金属;E的前三电离能较小,第四电离能突然增大,说明此元素的化合价为+3,为铝元素,而D的第一电离能比E略大且相邻,所以D为镁,原因是镁的p轨道全空,能量更低更稳定
考点:考查元素周期表、元素周期律的应用,电子式、化学式、离子方程式的书写,元素电离能的应用


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分,请回答有关问题:
| | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | | ① | ② | ③ | |
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E是位于短周期的主族元素,其中A、B为金属元素。已知:①热稳定性:HmD>HmC;②Cm-、E(m-1)-具有相同的电子层结构;③B与E在同一周期,在该周期中,E的原子半径最小,B的离子半径最小;④A、B所形成的单核离子具有相同的电子层结构,B的最高价氧化物对应的水化物与A、E的最高价氧化物对应的水化物都能反应。依据上述信息用相应的化学用语回答下列问题:
(1)HmD的电子式:________。
(2)Cm-和E(m-1)-的还原性强弱为________>________,能证明其还原性强弱的离子方程式为________________________________________。
(3)写出B的最高价氧化物对应的水化物和A的最高价氧化物对应的水化物反应的离子方程式_____________________________________。
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液等体积混合,所得溶液显碱性,溶液中离子浓度由大到小的顺序为________。
(5)在B、C、E单质中,符合下列转化关系的是________。
单质 化合物一
化合物一 化合物二
化合物二 最高价氧化物
最高价氧化物
对应的水化物
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)写出表示含有8个质子,10个中子的原子的化学符号________;
(2)已知阴离子aX2-和阳离子bYn+具有相同的核外电子排布,则a、b、n之间的关系为a=________;
(3)比较下列大小(填“>”或“<”)
A.原子半径:Cl______Na
B.酸性:H2CO3______H2SiO3
(4)某元素R气态氢化物的化学式为RH3,其最高价氧化物中含氧量为 ,已知该元素的原子核中中子数和质子数相等,则该元素的名称是________。
,已知该元素的原子核中中子数和质子数相等,则该元素的名称是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
I.已知几种元素原子的价电子构型为3s2,4s2,4s24p1,3d54s2,3s23p3,它们分别属于第几周期?第几族?最高化合价是多少?各元素符号分别是什么?
Ⅱ.第四周期的A、B、C、D四种元素,其价电子数依次为1、2、2、7,其原子序数依次增大。已知A与B 的次外层电子数均为8,而C与D的次外层电子数均为18。根据原子结构,判断:
(1)A、B、C、D的元素符号分别是________、________、________、________。
(2)写出D与A的简单离子的电子排布式________,________。
(3)哪一种元素的氢氧化物碱性最强?__________________________________________。
(4)B与D两原子间能形成何种化合物?________________。写出化学式及电子式________________,________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息见下表:
| 元素 | 相关信息 |
| X | X的基态原子核外的三个能级上电子数相等 |
| Y | Y与X同周期,Y基态原子p能级的成对电子数与未成对电子数相等 |
| Z | Z的单质是一种银白色活泼金属,在空气中燃烧后生成淡黄色的固体 |
| W | 向含W2+的溶液中滴加强碱,其白色氢氧化物在空气中迅速变成灰绿色,最后变成红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为保持街道整洁、湿润,在路面或广场上喷洒含化学式为XY2的溶液作保湿剂。X原子的结构示意图为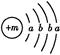 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m= ,该保湿剂的化学式为
(2)Z、W元素的名称为 、
(3)下列说法中正确的是
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是
A.XY2的电子式:X2+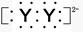
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2- 2Y-+Z↓
2Y-+Z↓
D.用电子式表示XY2的形成过程为: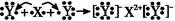
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下列关于元素周期律和元素周期表的论述中正确的是( )。
| A.同一主族的元素从上到下金属性逐渐减弱 |
| B.元素周期表是元素周期律的具体表现形式 |
| C.同一周期从左到右,元素原子半径逐渐增大 |
| D.非金属元素的最高正化合价等于它的负化合价的绝对值 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com