
【题目】下列物质在生活中应用时,起还原作用的是( )
A.三氯化铁作净水剂
B.硅胶作干燥剂
C.漂粉精作消毒剂
D.铁粉作食品袋内的脱氧剂
科目:高中化学 来源: 题型:
【题目】下列保存物质或试剂的方法不正确的是
A.实验室保存溴时,常在保存液溴的试剂瓶中加入少量水来防止溴挥发
B.盛放溴水的试剂瓶不能用橡胶塞
C.新制氯水应密封保存在棕色试剂瓶中
D.取碘水于试管中,加入CCl4,振荡后静置,溶液分层,上层呈紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子晶体熔点的高低决定于阴、阳离子之间距离、晶格能的大小,据所学知识判断KCl、NaCl、CaO、BaO四种晶体熔点的高低顺序是( )
A. KCl>NaCl>BaO>CaO B. NaCl>KCl>CaO>BaO
C. CaO>BaO>KCl>NaCl D. CaO>BaO>NaCl>KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.0 L恒容密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)![]() Y(g)+Z(g) ΔH<0,容器内气体总压强p随反应时间t的变化关系如图所示。以下分析正确的是( )
Y(g)+Z(g) ΔH<0,容器内气体总压强p随反应时间t的变化关系如图所示。以下分析正确的是( )
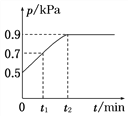
A. 该温度下此反应的平衡常数K=3.2
B. 从反应开始到t1时的平均反应速率v(X)=![]() mol·L-1·min-1
mol·L-1·min-1
C. 欲提高平衡体系中Y的百分含量,可加入一定量的X
D. 其他条件不变,再充入0.1 mol气体X,平衡正向移动,X的转化率减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加,W、X、Y、Z组成的单质可发生如下图所示的化学反应。B是生活中最常见的液体,Y、Z组成的化合物的水溶液呈中性。下列说法错误的是

A. 离子半径:Z>Y
B. A与B的反应一定是化合反应
C. Y、Z二者的最高价氧化物的水化物能发生反应
D. 将等物质的量的A、C同时溶于水中,所得溶液的pH>7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废钡渣(主要成分为BaS2O3,含少量SiO2)为原料生产高纯氟化钡的流程如下:

已知:Ksp(BaS2O3)=6.96×10-11,Ksp(BaF2)=1.0×10-6
(1)加入盐酸时除产生SO2外,还有淡黄色固体生成。该反应的离子方程式为____________。
(2)滤液的主要成分有_____________。(填化学式)
(3)工业上可用氨水吸收SO2,并通入空气使其转化为氨态氮肥。该转化中氧化剂与还原剂的物质的量之比为_______________。
(4)加入NaOH溶液的目的是中和过量的盐酸,但不宜过量,其原因是_____________(用离子反应方程式表示)。
(5)生成BaF2的反应的化学方程式为______________。
①若该反应温度过高,容易造成c(F-)降低的原因是___________________。
②研究表明,适当增加NH4F的比例有利于提高BaF2的产率和纯度。将浓度为0.1mol·L-1的BaCl2溶液和0.22 mol·L-1NH4F溶液等体积混合,所得溶液中c(Ba2+)=______mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com