
【题目】过氧化钙晶体(CaO2·8H2O)常温下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用于鱼类长途运输的增氧剂等。
⑴过氧化钙晶体可用下列方法制备:CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl。
用如下制取装置制备过氧化钙晶体。
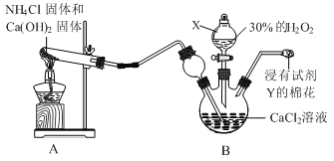
①装置A中发生反应的化学方程式为______。
②仪器X的名称为______;Y是______。
③为提高CaO2·8H2O产率,装置B的温度需控制在0℃,可采取的方法是______。
⑵测定产品中CaO2·8H2O含量的实验步骤如下:
步骤一:准确称取0.5000 g产品于有塞锥形瓶中,加入适量蒸馏水和过量的KI晶体,再滴入2 mol·L—1的硫酸溶液,充分反应。
步骤二:向上述锥形瓶中加入几滴淀粉溶液,逐滴加入浓度为0.200 mol·L—1的Na2S2O3溶液至反应完全,滴定至终点,消耗Na2S2O3溶液体枳为20.00 mL。求产品中CaO2·8H2O的质量分数。(写出计算过程)_____________
已知:CaO2·8H2O+2KI+2H2SO4=CaSO4+2K2SO4+I2+10H2O
I2+2S2O32-=2I-+ S4O62-
【答案】2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 分液漏斗 稀硫酸 将装置B置于冰水浴中 n(Na2S2O3)=0.200 mol·L-1×20.00 mL×10﹣3=0.004 mol,由关系式“CaO2·8H2O~I2~2S2O32-”可知,n(CaO2·8H2O)= 0.5×0.004mol=0.002 mol,m(CaO2·8H2O)=0.002mol×216g·mol-1=0.432 g,则样品中CaO2·8H2O的质量分数为:ω(CaO2·8H2O)=
CaCl2+2NH3↑+2H2O 分液漏斗 稀硫酸 将装置B置于冰水浴中 n(Na2S2O3)=0.200 mol·L-1×20.00 mL×10﹣3=0.004 mol,由关系式“CaO2·8H2O~I2~2S2O32-”可知,n(CaO2·8H2O)= 0.5×0.004mol=0.002 mol,m(CaO2·8H2O)=0.002mol×216g·mol-1=0.432 g,则样品中CaO2·8H2O的质量分数为:ω(CaO2·8H2O)= ![]() =86.4%。
=86.4%。
![]()
【解析】
根据装置图可知,A是用氯化铵与氢氧化钙加热制氨气,据此书写化学方程式;根据仪器的结构和性能确定仪器X的名称;利用反应Ca2++H2O2+2NH3+8H2O═CaO28H2O↓+2NH4+,在碱性环境下制取CaO2,常用冰水浴控制温度在0℃左右,其可能的原因为:温度低可减少过氧化氢的分解,提高过氧化氢的利用率,该反应是放热反应,温度低有利于提高CaO28H2O产率;根据反应的离子方程式:CaO2+4H++2I-═Ca2++2H2O+I2,I2+2S2O32-→2I-+S4O62-,可得关系式“CaO2·8H2O~I2~2S2O32-”,并以此进行计算。
(1)①根据装置图可知,A是用氯化铵与氢氧化钙加热制氨气,反应的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
②仪器X为分液漏斗,Y是稀硫酸,用于吸收挥发出来的氨气;故答案为:分液漏斗;稀硫酸;
③装置B的温度需控制在0℃,可采取的方法是将装置B置于冰水浴中,故答案为:将装置B置于冰水浴中;
(2)根据反应的离子方程式:CaO2+4H++2I-═Ca2++2H2O+I2,I2+2S2O32-→2I-+S4O62-,可得关系式CaO2~2S2O32-,n(Na2S2O3)=0.200 mol·L-1×20.00 mL×10﹣3=0.004 mol,由关系式“CaO2·8H2O~I2~2S2O32-”可知,n(CaO2·8H2O)=0.5×0.004mol=0.002 mol,m(CaO2·8H2O)=0.002mol×216g·mol-1=0.432 g,则样品中CaO2·8H2O的质量分数为:ω(CaO2·8H2O)= ![]() =86.4%。
=86.4%。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图某工厂用NO气体制取NH4NO3溶液,下列说法正确的是
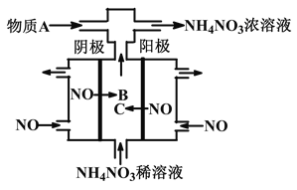
A. 阳极的电极反应式为:NO-3e-+2H2O=NO2-+4H+
B. 物质B与物质C是同一种物质
C. A物质可为氨气
D. 阴、阳两极转移的电子数之比为5∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1000mol/LBOH溶液滴定20mL 0.1000mol/L一元酸HA溶液,其滴定曲线如右图所示。下列说法正确的是

A. HA的电离平衡常数Ka为1×10-14
B. 滴定时应选择甲基橙作指示剂
C. 当滴入BOH溶液20 mL时,溶液中:c( B+)=c(A-) > c(OH- ) = c(H+)
D. 当滴入BOH溶液10 mL时,溶液中:c(A-)> c(B+)> c(H+)> c( OH- )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲硅烷广泛用于电子工业、汽车领域,三氯氢硅(SiHCl3)是制备甲硅烷的重要原料。回答下列问题:
(1)工业上以硅粉和氯化氢气体为原料生产SiHCl3时伴随发生的反应有:
Si(s)+4HCl(g)= SiCl4(g)+2H2(g) H=-241kJ/mol
SiHCl3(g)+HCl(g)=SiCl4(g)+H2(g) H=-31kJ/mol
以硅粉和氯化氢气体生产SiHCl3的热化学方程式是____________________________。
(2)工业上可用四氯化硅和氢化铝锂(LiAlH4)制甲硅烷,反应后得甲硅烷及两种盐。该反应的化学方程式为_________________。
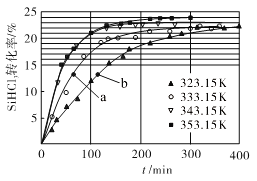
(3)三氯氢硅歧化也可制得甲硅烷。反应2SiHCl3(g) ![]() SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
①353.15K时,平衡转化率为_________,反应的平衡常数K=________(保留3位小数)。该反应是________反应(填“放热”“吸热”)。
②323.15K时,要缩短反应达到平衡的时间,可采取的措施有_________、__________。
③比较a、b处反应速率的大小:va_____vb (填“>”“<”或“=”)。已知反应速率v正=![]() ,v逆=
,v逆=![]() ,k1、k2分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在353.15K时
,k1、k2分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在353.15K时![]() =________(保留3位小数)。
=________(保留3位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
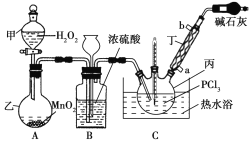
【题目】三氯氧磷(POCl3)是一种工业化工原料,可用于制取有机磷农药、长效磺胺药物等,还可用作染料中间体、有机合成的氯化剂和催化剂、阻燃剂等。利用O2和PCl3为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
已知PCl3和三氯氧磷的性质如表:
熔点/℃ | 沸点/℃ | 其他物理或化学性质 | |
PCl3 | -112.0 | 76.0 | PCl3和POCl3互溶,均为无色液体,遇水均剧烈水解,发生复分解反应生成磷的含氧酸和HCl |
POCl3 | 1.25 | 106.0 |
(1)装置A中的分液漏斗能否用长颈漏斗代替?做出判断并分析原因:_______
(2)装置B的作用是______________(填标号)。
a.气体除杂 b.加注浓硫酸 c.观察气体流出速度 d.调节气压
(3)仪器丙的名称是___________,实验过程中仪器丁的进水口为__________(填“a”或“b”)口。
(4)写出装置C中发生反应的化学方程式_______,该装置中用温度计控制温度为60~65 ℃,原因是________。
(5)称取16.73 g POCl3样品,配制成100 mL溶液;取10.00 mL溶液于锥形瓶中,加入3.2 mol·L-1的AgNO3溶液10.00 mL,并往锥形瓶中滴入5滴Fe2(SO4)3溶液;用0.20 mol·L-1的KSCN溶液滴定,达到滴定终点时消耗KSCN溶液10.00 mL(已知:Ag++SCN-=AgSCN↓)。则加入Fe2(SO4)3溶液的作用是________,样品中POCl3的纯度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,下列关于该有机物的性质说法正确的是( )
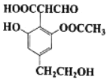
A.可与银氨溶液反应,不与![]() 溶液反应显色
溶液反应显色
B.可以与![]() 反应,1 mol该物质最多消耗
反应,1 mol该物质最多消耗![]()
C.1 mol该物质与足量金属Na反应,最多产生![]()
D.1 mol物质与NaOH溶液反应,最多消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种重要的化工原料,用来制取一系列硝酸盐类氮肥,如硝酸铵、硝酸钾等;也用来制取含硝基的炸药等。试回答下列问题:
(1)某同学对铁与稀硝酸的反应进行探究,若HNO3只被还原成NO,则:
①写出铁与过量稀硝酸反应的离子方程式:__。
②写出过量铁与稀硝酸反应的离子方程式:__。
③若28g铁与含1.6mol硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比为__。上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,最终得到的固体质量为__g。
(2)饮用水中NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式:__Al+__NO3-+__OH-+__=__[Al(OH)4]-+__N2↑。
②上述反应中,还原剂与还原产物的物质的量之比是__,反应中转移电子0.3mol,生成__mL(标准状况下)N2。
【答案】Fe+NO3-+4H+=Fe3++NO↑+2H2O 3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O 2∶3 40 10 6 4 18H2O 10 3 10∶3 672
【解析】
(1)①铁与过量稀硝酸反应生成硝酸铁、NO和水,离子方程式为Fe+NO3-+4H+=Fe3++NO↑+2H2O;
②过量铁与稀硝酸反应生成硝酸亚铁、NO和水,离子方程式为3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O;
③28g铁的物质的量为0.5mol,与含1.6mol硝酸的稀硝酸恰好完全反应,设生成的Fe3+和Fe2+的物质的量分别是xmol、ymol,即生成xmol硝酸铁和ymol硝酸亚铁,根据N原子守恒知,生成NO的物质的量为(1.6-3x-2y)mol,根据得失电子守恒有3x+2y=3(1.6-3x-2y),又有x+y=0.5,解得x=0.2,y=0.3,则生成的Fe3+和Fe2+的物质的量之比为2∶3;上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,由于生成的氢氧化亚铁在空气中易被氧化为氢氧化铁,氢氧化铁受热分解最终得到的固体是氧化铁,故其物质的量为0.5mol×![]() =0.25mol,质量为40g;
=0.25mol,质量为40g;
(2)①根据得失电子守恒、原子守恒及电荷守恒,可知离子方程式为10Al+6NO3-+4OH-+18H2O=10[Al(OH)4]-+3N2↑;
②上述反应中,还原剂是Al,还原产物是N2,其物质的量之比为10∶3;由方程式可知,生成3molN2时转移电子30mol,所以反应中转移电子0.3mol,生成N2的体积(标准状况下)为![]() ×22.4L·mol-1=0.672L=672mL。
×22.4L·mol-1=0.672L=672mL。
【点睛】
金属与硝酸反应的计算一般常采用以下方法:①原子守恒法:HNO3与金属反应时,一部分HNO3起酸的作用,以NO的形式存在于溶液中;一部分作为氧化剂转化为还原产物,这两部分中氮原子的总物质的量等于反应消耗的HNO3中氮原子的物质的量;②得失电子守恒法:HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得到电子的物质的量等于金属失电子的物质的量;③电荷守恒法:HNO3过量时反应后溶液中(不考虑OH-)有:c(NO3-)=c(H+)+nc(Mn+)(Mn+代表金属离子);④离子方程式计算法:金属与H2SO4、HNO3的混合酸反应时,由于溶液中NO3-在H2SO4提供H+的条件下能继续与金属反应,因此此类题目应用离子方程式来计算,先作过量判断,然后根据完全反应的金属或H+或NO3-进行相关计算,且溶液中要符合电荷守恒。
【题型】综合题
【结束】
21
【题目】如图是氮元素的几种价态与物质类别的对应关系。请回答下列问题:
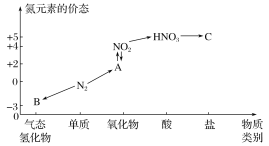
(1)写出N2的一种用途:___。
(2)HNO3与图中的物质C常用于检验Cl-的在,则C的化学式为___。
(3)实验室制取物质B的化学方程式为____。
(4)NO2与水反应生成物质A的化学方程式为____。
(5)浓硝酸与木炭在加热条件下反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W、M 均为短周期元素。25℃时,其最高价氧化物对应的水化物(浓度均为0.01mol/L)溶液的pH和原子半径的关系如图所示。下列说法不正确的是

A. X、M 简单离子半径大小顺序:X>M
B. X、Y、Z、W、M 五种元素中只有一种是金属元素
C. Z 的最高价氧化物的化学式为ZO3
D. X、Z的最简单气态氢化物反应现象:有白烟生成XY ZW
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com