
【题目】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;![]() 原子核外有3层电子且各层均处于全满状态。
原子核外有3层电子且各层均处于全满状态。
(1)E元素基态原子的价电子排布式为__。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为__(填元素符号),电负性数值由大到小的顺序为__(填元素符号)。
(3)B元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为__,C元素的气态氢化物的VSEPR模型为__。B2A4是重要的基本石油化工原料,1molB2A4分子中含__molσ键。写出与BD2为等电子体关系的分子、阳离子、阴离子各一个__、__、__。
(4)E单质晶胞的形成方式为图1中的哪一种:__(填ABA或ABC),其空间利用率为__。
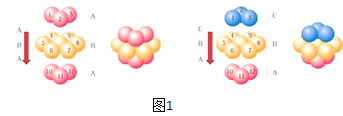
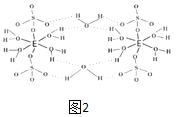
(5)E的硫酸盐结构如图2,此化合物是__(写名称),在图中画出以E为中心原子的配位键___。
【答案】3d104s1 C<O<N O>N>C sp2 四面体 5 CS2 NO2+ SCN-或N3- ABC 74% 五水硫酸铜 
【解析】
A、B、C、D、E五种元素的原子序数依次增大,A原子所处的周期数、族序数都与其原子序数相等,则A为H元素;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍,则B原子核外有6个电子,则B为C元素;D原子L层上有2对成对电子,则D原子电子排布式为![]() ,所以D为O元素;C的原子序数介于碳、氧元素之间,则C为N元素;
,所以D为O元素;C的原子序数介于碳、氧元素之间,则C为N元素;![]() 原子核外有3层电子且各层均处于全满状态,则E原子核外电子数为
原子核外有3层电子且各层均处于全满状态,则E原子核外电子数为![]() ,则E为Cu元素。
,则E为Cu元素。
(1)E为Cu元素,基态原子的核外电子排布式为:![]() ,则其基态原子的价电子排布式为:
,则其基态原子的价电子排布式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)同周期,随原子序数增大元素第一电离能呈增大趋势,但氮元素2p能级为半满稳定状态,能量较低,失去第一个电子需要的能量较多,其第一电离能高于同周期相邻元素,故C、N、O三种元素的第一电离能数值由小到大的顺序为![]() ;
;
非金属性越强,其电负性越强,非金属性:![]() ,则C、N、O三种元素的电负性大小为:
,则C、N、O三种元素的电负性大小为:![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(3)B元素的最高价氧化物对应的水化物是碳酸,碳酸中中心原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论知,C原子杂化方式为![]() ;
;
C为N元素,其氢化物是![]() ,氨气分子中N原子价层电子对个数是4且含有1个孤电子对,VSEPR模型为四面体结构;
,氨气分子中N原子价层电子对个数是4且含有1个孤电子对,VSEPR模型为四面体结构;
1个![]() 分子中含有5个
分子中含有5个![]() 键,1个
键,1个![]() 键,则
键,则![]() 分子中含有
分子中含有![]() 键;
键;
与![]() 互为等电子体的分子、离子中含有3个原子,16个价电子,所以其等电子体的分子、阳离子、阴离子的化学式依次为:
互为等电子体的分子、离子中含有3个原子,16个价电子,所以其等电子体的分子、阳离子、阴离子的化学式依次为:![]() 、
、![]() 、
、![]() 或
或![]() ,
,
故答案为:![]() ;四面体; 5;
;四面体; 5;![]() ;
;![]() ;
;![]() 或
或![]() ;
;
(4)E为铜元素,Cu为面心六方密堆积,为ABC型方式堆积,其其空间利用率为![]() ,
,
故答案为:ABC;![]() ;
;
(5)该盐为硫酸铜,根据图2可知,该化合物分子中含有5个结晶水分子,为无水硫酸铜;该配合物中,铜原子提供空轨道,水中氧原子提供孤电子对,配位键由提供孤电子对的原子指向提供空轨道的原子,所以以Cu为中心原子的配位键为: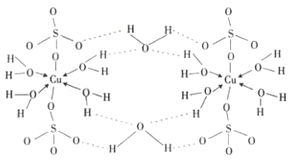 ,
,
故答案为:五水硫酸铜; 。
。


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】直接排放SO2、NO2会危害环境。工业上常采用化学方法控制污染。
(1)下图是1mol CH4完全燃烧生成气态水的能量变化和1molS(g)燃烧的能量变化。

①CH4完全燃烧的活化能是_____________kJ/mol
②在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式_____________________________;
(2)为减少SO2排放,将含SO2的烟气通过洗涤剂X,充分吸收后再向吸收后的溶液中加入稀硫酸,既可以回收![]() ,同时又可得到化肥。X可以是__________(填序号)。
,同时又可得到化肥。X可以是__________(填序号)。
a.Ca(OH)2 b.K2CO3 c.Na2SO3 d.NH3H2O
(3)对NO2+SO2![]() SO3+NO △H<0反应进行探究:在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率。实验结果如图所示:
SO3+NO △H<0反应进行探究:在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率。实验结果如图所示:

①能够加快该化学反应速率的外界条件是___________________
a.降低温度 b.增大压强 c.升高温度 d.减小压强
②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是___________;
③若A点对应实验中,SO2(g)的起始浓度为c0mol/L,经过![]() min达到平衡状态,该时段化学反应速率v(NO2)___mol/(Lmin);
min达到平衡状态,该时段化学反应速率v(NO2)___mol/(Lmin);
④图中C、D两点对应的实验温度分别为![]() 和
和![]() ,计算判断
,计算判断![]() ______
______![]() (填>、=、或<)
(填>、=、或<)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室验证钠能与二氧化碳发生反应,并确定其产物的装置如图所示(已知:PdC12溶液遇CO能产生黑色的Pd),下列说法错误的是

A. 装置①的仪器还可以制取H2、NH3等气体
B. 装置⑤中石灰水变浑浊后,再点燃酒精灯
C. 装置②③中分别盛装饱和Na2CO3溶液、浓H2SO4
D. 装置⑥中有黑色沉淀,发生的反应是PdC12+CO+H2O=Pd↓+CO2+2HC1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+nB(g)![]() pC(g)的速率和平衡的影响,图像如下,下列判断正确的是( )
pC(g)的速率和平衡的影响,图像如下,下列判断正确的是( )

A. 由图a可知,T1>T2,该反应的逆反应为吸热反应
B. 由图b可知,该反应m+n<p
C. 图c是绝热条件下速率和时间的图像,由此说明该反应吸热
D. 图d中,若m+n=p,则曲线a一定增大了压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安全是顺利进行实验及避免伤害的保障.下列实验操作正确且不是从实验安全角度考虑的是( )

A. 操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B. 操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
C. 操作③:吸收氨气或氯化氢气体并防止倒吸
D. 操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分元素的性质与原子![]() 或分子
或分子![]() 结构如表所示:
结构如表所示:
元素编号 | 元素性质与原子 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的金属离子中半径最小 |
(1)画出元素T的原子结构示意图:__。
(2)元素Y与元素Z相比,金属性较强的是__![]() 用元素符号表示
用元素符号表示![]() ,下列表述中能证明这一事实的是___
,下列表述中能证明这一事实的是___![]() 填字母
填字母![]() 。
。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质与水反应剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中的两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式:__。
(4)T可以形成稳定的阴离子Tm-,Y可以形成稳定的阳离子Yn+,其半径关系为r(Tm-)__r(Yn+)(填“>”,“<”或“=”)
(5)X、Y、Z的最高价氧化物对应的水化物可以相互发生反应,写出Y、Z的最高价氧化物对应的水化物之间反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁条和铝片为电极,并用导线连接同时插入NaOH溶液中,下列说法正确的是
A.镁条作负极,电极反应:Mg-2e-=Mg2+
B.铝片作负极,电极反应:Al+4OH--3e-=AlO2-+2H2O
C.电流从Al电极沿导线流向Mg电极
D.铝片上有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示仪器可用于实验室制备少量无水![]() ,仪器连接顺序正确的是( )
,仪器连接顺序正确的是( )
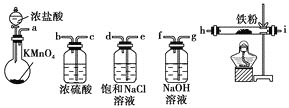
A.a→b→c→d→e→i→h→fB.a→e→d→c→b→h→i→g
C.a→d→e→c→b→h→i→gD.a→c→b→d→e→h→i→f
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.0.1mol/L氨水中滴入等浓度等体积的醋酸,溶液导电性增强
B.适当升高温度,CH3COOH溶液pH增大
C.稀释0.1 mol/L NaOH溶液,水的电离程度减小
D.CH3COONa溶液中加入少量CH3COOH,![]() 减小
减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com