
【题目】镁条和铝片为电极,并用导线连接同时插入NaOH溶液中,下列说法正确的是
A.镁条作负极,电极反应:Mg-2e-=Mg2+
B.铝片作负极,电极反应:Al+4OH--3e-=AlO2-+2H2O
C.电流从Al电极沿导线流向Mg电极
D.铝片上有气泡产生
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知断裂1mol化学键所需的能量(kJ):N≡N键为942、N—N键为154、N—H键为391、H—O键为463。有关化学反应的能量变化如图所示。下列说法正确的是( )
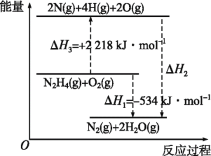
A.ΔH2=ΔH1+ΔH3
B.断裂1molO2(g)中的共价键需要吸收500kJ的能量
C.ΔH2>ΔH1
D.N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH=-534kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.分子式满足C6H12的有机物所有碳原子可能位于同一平面上
B.1mol乙烷在光照条件下最多能与3molCl2发生取代反应
C.甲烷、苯和油脂均不能使酸性KMnO4溶液褪色
D.分子式为C4H10O且能与金属钠反应的有机物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;![]() 原子核外有3层电子且各层均处于全满状态。
原子核外有3层电子且各层均处于全满状态。
(1)E元素基态原子的价电子排布式为__。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为__(填元素符号),电负性数值由大到小的顺序为__(填元素符号)。
(3)B元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为__,C元素的气态氢化物的VSEPR模型为__。B2A4是重要的基本石油化工原料,1molB2A4分子中含__molσ键。写出与BD2为等电子体关系的分子、阳离子、阴离子各一个__、__、__。
(4)E单质晶胞的形成方式为图1中的哪一种:__(填ABA或ABC),其空间利用率为__。
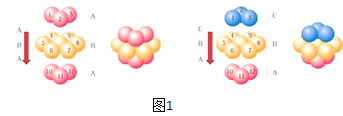
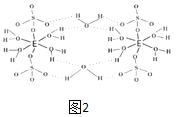
(5)E的硫酸盐结构如图2,此化合物是__(写名称),在图中画出以E为中心原子的配位键___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中一定能大量共存的是( )
A. 含有大量 Ba2+的溶液中:Cl- K+ ![]()
![]()
B. 含有大量H+的溶液中:Mg2+ Na+ ![]()
![]()
C. 含有大量OH-的溶液中:Mg2+ ![]()
![]()
![]()
D. 含有大量Na+的溶液中:H+ K+ ![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H2(g)+![]() O2(g)=H2O(g) ΔH1=akJ·mol1
O2(g)=H2O(g) ΔH1=akJ·mol1
②2H2(g)+O2(g)=2H2O(g) ΔH2=bkJ·mol1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=ckJ·mol1
O2(g)=H2O(l) ΔH3=ckJ·mol1
④2H2(g)+O2(g)=2H2O(l) ΔH4=d kJ·mol1
下列关系式中正确的是
A.a<c<0B.b>d>0C.2a=b<0D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL 0.3mol·L-1 Na2SO4溶液和50mL 0.2mol·L-1 Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为(假设混合前后溶液体积变化忽略不计)( )
A.0.20mol·L-1B.0.25mol·L-1C.0.40mol·L-1D.0.50mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:
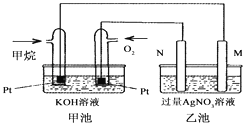
(1)M电极的材料是________,其电极反应式为:________N的电极名称是________,电极反应式为:________
(2)通入甲烷的铂电极的电极反应式为________.
(3)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为________ L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为______,3d能级上的未成对电子数为_______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是________。
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是______。
③氨的沸点_______(填“高于”或“低于”)膦(PH3),原因是_______;氨是______分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)铜晶体铜碳原子的堆积方式如图所示。
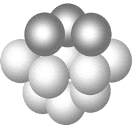
①基态铜在元素周期表中位置__________________。
②每个铜原子周围距离最近的铜原子数目_________。
(4)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(黑点代表铜原子)。
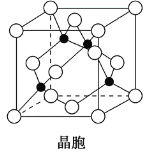
①该晶体的化学式为__________________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于________(填“离子”或“共价”)化合物。
③已知该晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为________pm(只写计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com