
在一定温度下,向饱和烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原温度,关于溶液下列说法正确的是( )
|
| A. | 有晶体析出,Na+ 数目不变 | B. | 有气体逸出,Na+ 数目增加 |
|
| C. | Na+数目不变,溶质的质量分数不变 | D. | Na+数目减少,有气体逸出 |
| 钠的重要化合物. . | |
| 专题: | 几种重要的金属及其化合物. |
| 分析: | 过氧化钠和水反应生成氢氧化钠和氢气,消耗水,饱和的烧碱溶液中有NaOH析出,有氧气放出,得到的溶液仍然是饱和氢氧化钠溶液,据此回答判断. |
| 解答: | 解:过氧化钠和水发生:2Na+2H2O=2NaOH+H2↑,消耗水,饱和的烧碱溶液中有NaOH析出,溶液中Na+数目减少,但反应后仍为饱和溶液,溶液的pH不变,溶液中c(Na+)不变. A、有晶体析出,Na+数目减少,故A错误; B、有氧气放出,Na+数目减少,故B错误; C、Na+数目减少,溶质的质量分数不变,故C错误; D、有氧气放出,Na+数目减少,故D正确; 故选D. |
| 点评: | 本题考查过氧化钠的性质,注意饱和溶液的性质,溶剂减小,溶液中要析出晶体,但溶液的浓度不变,为易错点. |


科目:高中化学 来源: 题型:
A~G各物质间的关系如图,其中B、D为气态单质.
请回答下列问题:
(1)物质C和E的名称分别为 浓盐酸 、 四氧化三铁 ;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为 2H2O2═2H2O+O2↑ ;若只能在加热情况下进行,则反应物A应为 KClO3 ;
(3)反应②的化学方程式为 4HCl(浓)+MnO2 MnCl2+2H2O+Cl2↑ ;
MnCl2+2H2O+Cl2↑ ;
(4)新配制的F溶液应加入 铁粉 以防止其转化为G.检验G溶液中阳离子的常用试剂是 KSCN溶液 ,实验现象为 溶液变成红色 .
查看答案和解析>>
科目:高中化学 来源: 题型:
美国斯坦福大学研究人员发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl.下列有关“水”电池在海水中放电时的说法正确的是( )
|
| A. | 负极反应式:Ag+Cl﹣+e﹣═AgCl |
|
| B. | 电池的正极用二氧化锰纳米棒为材料,可大大提高发电效率 |
|
| C. | Na+不断向“水”电池的负极移动 |
|
| D. | 每转移2 mol电子,正极就有5 mol MnO2被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于溶液中微粒的浓度,下列说法正确的是
A.0.1mol·L-1的(NH4)2SO4溶液中:c(SO42-) > c(NH4+) > c(H+) > c(OH-)
B.等浓度等体积的NaHSO3溶液与NaClO溶液混合后:
c(Na+) + c(H+) = c(HSO3-) + c(ClO-) + 2c(SO32-) + c(OH-)
C.等浓度等体积的NaHCO3溶液与NaCl溶液混合后:
1/2 c(Na+) = c(HCO3-) + c(CO32-) + c(H2CO3)
D.标况下,将2.24LSO2气体通入到100ml 1mol·L-1的NaOH溶液中,完全反应
后溶液呈酸性,则该溶液中:c(Na+) > c(HSO3-) > c(SO32-) >c(H+) > c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ. 在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g) 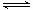 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12[来源:Z§xx§k.Com] | 0.11 | 0.10 | 0.10 |
(1)反应前2min的平均速率ν(Z)= ,该温度下此反应的平衡常数K=
(2)其他条件不变,若降低温度,反应达到新平衡前ν(逆) ν(正) (填“>”,“<”或“=”)
(3)其他条件不变,若再充入0.2molZ,平衡时X的体积分数 (填“增大”,“减小”或“不变”)
Ⅱ. 某电解池装置如下图所示:
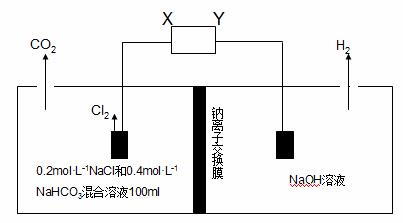
(1)外电源的负极是 (填“X”或“Y”)
(2)阳极室中发生的反应依次为 ,
(3)若外电路转移0.02mol电子,则膜两侧溶液质量变化差△m左 – △m右= g
查看答案和解析>>
科目:高中化学 来源: 题型:
用固体NaOH配制物质的量浓度溶液时,下列操作会导致溶液浓度偏低的是( )
|
| A. | 在烧杯中溶解时,有少量液体溅出 | B. | 样品中含有少量Na2O杂质 |
|
| C. | 容量瓶使用前用NaOH溶液润洗 | D. | 定容时俯视容量瓶刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子组在溶液中可以大量共存的是( )
|
| A. | pH=0的溶液中:Na+、CH3COO﹣、Cl﹣、Cu2+ |
|
| B. | pH=14的溶液中:H+、NH4+、SO42﹣、SO32﹣ |
|
| C. | 使pH试纸变红的溶液中:Fe2+、CO32﹣、NO3﹣、Cl﹣ |
|
| D. | 强酸性澄清透明溶液中:Al3+、K+、NO3﹣、MnO4﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中Cl-的物质的量浓度与50mL 1mol?L-1 AlCl3溶液中Cl-的物质的量浓度相等的是( )
| A.150mL 1mol?L-1的NaCl溶液 |
| B.50mL 1mol?L-1的CaCl2溶液 |
| C.150mL 3mol?L-1的KCl溶液 |
| D.150mL 3mol?L-1的MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学已渗透到人类生活的各个方面.下列说法不正确的是( )
|
| A. | 阿司匹林具有解热镇痛作用 |
|
| B. | 可以用Si3N4、Al2O3制作高温结构陶瓷制品 |
|
| C. | 在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀 |
|
| D. | 禁止使用四乙基铅作汽油抗爆震剂,可减少汽车尾气污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com