
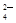 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):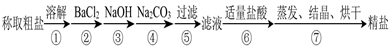
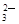 =CaCO3↓、Ba2++CO
=CaCO3↓、Ba2++CO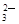 =BaCO3↓ 。
=BaCO3↓ 。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源:不详 题型:填空题
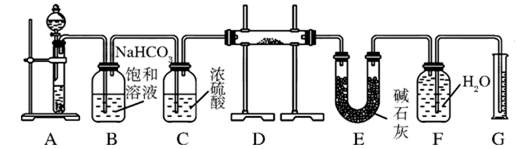
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2、O2、N2 | B.HCl、Cl2、CO2 | C.CH4、H2、CO | D.SO2、Cl2、O2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
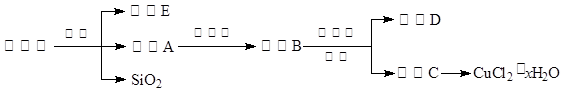
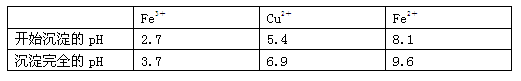
| A.氨水 | B.氧化铜 | C.氢氧化铜 | D.氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
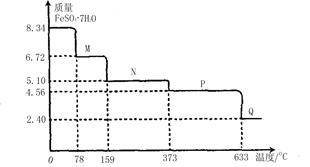
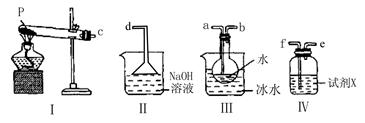
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.容量瓶使用前有蒸馏水 |
| B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 |
| C.俯视确定凹液面与刻度线相切 |
| D.称量NaOH固体时使用了称量纸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

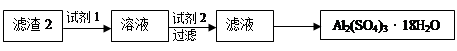
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com