
����Ŀ���綯�������õ��Ϊ����﮵�أ�����ʱԭ����ͼ��N�������ǽ���﮺�̼�ĸ��ϲ��ϣ������Ϊһ���ܴ���Li+�Ĺ������ʣ���ط�Ӧʽ��
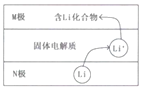
LixC6+Li1-xCoO2![]() C6+LiCoO2������˵��������ǣ�������
C6+LiCoO2������˵��������ǣ�������
A.�ŵ�ʱ���Ӵ�N������M��
B.�ŵ�ʱN�缫�ķ�ӦʽΪ��LixC6��xe��=xLi++C6
C.M�������ʾ��н�ǿ��ԭ��
D.����ڴ�ͳǦ���أ�﮵�صı������ϸ�
���𰸡�C
��������
���ݵ�ط�Ӧʽ֪���ŵ�ʱ������ӦʽΪLixC6��xe��=C6+xLi+��������ӦʽΪLi1-xCoO2+xLi++xe��=LiCoO2�����ʱ��������������Ӧʽ�븺����������Ӧʽ�����෴������N�Ǹ�����M��������
A���ŵ�ʱ���ӴӸ�����������������N��ͨ����������M������A��ȷ��
B���ŵ�ʱ��N�Ǹ���������ʧ���ӵ�������Ӧ���缫��ӦʽΪ��LixC6��xe��=C6+xLi+����B��ȷ��
C��M������������Ҫ���н�ǿ��ԭ�ԣ���C����
D����λ�������������Խ�࣬�������Խ�����Ԫ�ص�Ħ��������С����������ڴ�ͳǦ���أ�﮵�صı������ϸߣ���D��ȷ��
������������ΪC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ȼ�ϵ��ԭ���о������°��ĺϳɣ���ع���ʱMV2+/MV+�ڵ缫��ø֮�䴫�ݵ��ӣ�ʾ��ͼ������ʾ������˵���������
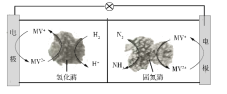
A. ������й�ҵ�ϳɰ����÷��������ºͣ�ͬʱ�����ṩ����
B. �����������⻯ø�����·�����ӦH2+2MV2+![]() 2H++2MV+
2H++2MV+
C. ���������̵�øΪ������N2������ԭ��Ӧ����NH3
D. ��ع���ʱ����ͨ������Ĥ�ɸ��������������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ķ����в��ϣ��������С�⡣
�������(K2FeO4)��һ�����͡���Ч�����ˮ���������乤ҵ�ϳ�ԭ��Ϊ��
��2Fe(OH)3��3NaClO��10NaOH��2Na2FeO4��6NaCl��8H2O
��Na2FeO4��2KOH![]() K2FeO4����2NaOH
K2FeO4����2NaOH
���������ˮ��Ӧ����Fe(OH)3����������ȡ�
��1�����ڷ�Ӧ������˵����ȷ����
A.Fe(OH)3�õ�����B.NaClOʧȥ����
C.NaClO����ԭD.NaOH��������
��2����Ӧ������
A.���Ϸ�ӦB.�ֽⷴӦC.�û���ӦD.���ֽⷴӦ
��3�����ڷ�Ӧ������˵����ȷ����
A.��СNa2FeO4Ũ���ܹ��ӿ췴Ӧ����
B.����KOHŨ���ܹ��ӿ췴Ӧ����
C.�����¶ȿ��Լ�����Ӧ����
D.����������KOH����ʹNa2FeO4100%ת��ΪK2FeO4
��4��NaClO����
A.������B.��C.��D.��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ŷ����γɳ�����ն������ꡢ��������Ҫ����֮һ��SCR���ǹ�ҵ��������������ij��÷�������Ӧԭ��Ϊ��4NH3(g)+4NO(g)+O2(g) ![]() 4N2(g)+6H2O(g) ��H<0
4N2(g)+6H2O(g) ��H<0
(1)���������ƻ�������ԭ��Ϊ����NO+O3![]() NO2+O2 ��NO2+O
NO2+O2 ��NO2+O![]() NO+O2�������·�Ӧ�ٵ�ƽ�ⳣ��ΪK1����Ӧ�ڵ�ƽ�ⳣ��ΪK2����ӦO3+O
NO+O2�������·�Ӧ�ٵ�ƽ�ⳣ��ΪK1����Ӧ�ڵ�ƽ�ⳣ��ΪK2����ӦO3+O![]() 2O2��ƽ�ⳣ��K ��_______(��K1��K2��ʾ)�����������ڸ÷�Ӧ�е�������___________��
2O2��ƽ�ⳣ��K ��_______(��K1��K2��ʾ)�����������ڸ÷�Ӧ�е�������___________��
(2)SCR����NOʱ��Ͷ�ϱ�һ��ʱ���������NOƽ��ת���ʵķ�Ӧ������________��________��
(3)����������ͬ���ڼס������ִ��������£�NOת�������¶ȵĹ�ϵ��ͼ��

�ٹ�ҵ��ѡ������ҵ�ԭ����______________��
���ڴ����������£�ͼ��M�㴦(��Ӧ�¶�Ϊ210��)NO��ת����__________(����������������һ����������һ��������)���¶��µ�ƽ��ת���ʡ�����210��ʱ��NOת���ʽ��͵�ԭ���������________����
A.�¶ȸ���210oC����Ӧ���ȣ�ƽ������
B.�������Խ���
C.�¶ȸ���210oC�������˸���Ӧ
(4)������(CH3-O-CH3)�����������Ϊ������ɼ��ٳ����ն������ö�����-O2ȼ�ϵ����Ϊ��Դ�����õ�ⷨ�Ʊ�����Cu2O����װ����ͼ��ʾ��

������װ����D�缫Ӧ���Ӷ�����ȼ�ϵ����ͨ_______(����CH3-O-CH3������O2��)��һ�����õ��������ӽ���ĤΪ_____���ӽ���Ĥ(����������������)��
�ڸõ��ص�������ӦʽΪ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������������Լ�����������ӦΪ��2NO2(g)+O3(g)N2O5(g)+O2(g)������Ӧ�ں����ܱ������н��У������ɸ÷�Ӧ���ͼ���������ж���ȷ����
A | B | C | D |
|
|
|
|
t1ʱ�����������ƽ�����������ƶ� | ��ƽ��ʱ�����ı�x����xΪc(O2) | �ӷ�Ӧ��ʼ��ƽ������Ũ�ȱ仯 | �����¶ȣ�ƽ�ⳣ����С |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦN2O4��g��NO2��g����H=+57kJmol��1�����¶�ΪTʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ��Ϊ�� ��

A.A��C����ķ�Ӧ���ʣ�v��A����v��C��
B.A��C�����������ɫ��A�Cdz
C.B�����淴Ӧ���ʣ�v��������v���棩
D.A��C�������ݵ�ƽ����Է���������A��C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�������X������Y��0.16mol����10L�����ܱ������У�������Ӧ��X��g��+Y��g��2Z��g����H��0��һ��ʱ���ﵽƽ�⣮��Ӧ�����вⶨ���������������˵����ȷ���ǣ�������
t�Mmin | 2 | 4 | 7 | 9 |
n��Y���Mmol | 0.12 | 0.11 | 0.10 | 0.10 |
A. ��Ӧǰ4min��ƽ����Ӧ��������Z��=0.0125molL-1min-1
B. �����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰ�����棩����������
C. �����������䣬�ٳ���0.2molZ����ƽ��ʱX�������������
D. ���¶��´˷�Ӧ��ƽ�ⳣ��K=1.44
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����ڹ�ҵ���������������й㷺Ӧ�á��ش��������⣺
��1�����������ȶ��������������������õ���ʽ��ʾ�������γɹ��̣�
��
��2������(N2H4)��һ�ֻ�ԭ������֪��H2O(l)=H2O(g) ��H=+44kJ/mol���Խ���±����ݣ�д��N2H4 (g)ȼ���ȵ��Ȼ�ѧ����ʽ�� ��
��ѧ�� | N��H | N��N | N=N | N��N | O=O | O��H |
����(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
��3��KCN�������ܽ����ܽ���±�����AgI����KCN��Һ�У��γ��ȶ���Ag(CN)2������ת�������ӷ���ʽΪ�� ������֪Ksp(AgI)=1.5��10��16��K��[Ag(CN)2��]=1.0��10-21��������ת������ʽ��ƽ�ⳣ��K= ��(��ʾ��K��Խ��ʾ�û�����Խ�ȶ�)
��4�����Ĵ��������ڹ�ҵ�������ᡣ�÷�Ӧ����Ƴ����͵�أ���д�����Ի����£��õ�صĸ����缫��Ӧʽ�� ��
��5����ijŨ�ȵ�NO2�������һ���ݾ��������У�������Ӧ2NO2![]()
![]() N2O4�����ͼ�����¡�
N2O4�����ͼ�����¡�
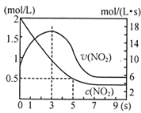
��0~3sʱv(NO2)�����ԭ���� ��
��5sʱNO2ת����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ����Ҫ�����ȼ�ϣ����������������������Գ��������ƻ����á���ҵ�Ͽ�����ú����������(ˮú��)�ϳɶ����ѡ���ش��������⣺
��1������ˮú���ϳɶ����ѵ��ܷ�ӦΪ��3H2(g)��3CO(g)![]() CH3OCH3(g)��CO2(g)����H����246.4 kJ��mol��1 �����Է�Ϊ��������Ӧ�ֱ����£�
CH3OCH3(g)��CO2(g)����H����246.4 kJ��mol��1 �����Է�Ϊ��������Ӧ�ֱ����£�
��4H2(g)��2CO(g)===CH3OCH3(g)��H2O(g)������H1����205.1 kJ��mol��1
��CO(g)��H2O(g)===CO2(g)��H2(g)����H2��________��
��2����һ�������µ��ܱ������У����ܷ�Ӧ�ﵽƽ�⣬ֻ�ı�һ��������ͬʱ��߷�Ӧ���ʺ�COת���ʵ���________(����ĸ����)��
A�������¶ȡ������������� B���������
C����С����������� D������H2��Ũ��
E������CO��Ũ��
��3����һ����ɱ���ܱ������г���3 mol H2��3 mol CO��1 mol CH3OCH3��1 mol CO2����һ���¶Ⱥ�ѹǿ�·�����Ӧ��3H2(g)��3CO(g)![]() CH3OCH3(g)��CO2(g)����һ��ʱ��ﵽƽ�⣬�����ƽ��ʱ��������ܶ���ͬ��ͬѹ����ʼʱ��1.6����
CH3OCH3(g)��CO2(g)����һ��ʱ��ﵽƽ�⣬�����ƽ��ʱ��������ܶ���ͬ��ͬѹ����ʼʱ��1.6����
�ʣ��ٷ�Ӧ��ʼʱ�����淴Ӧ���ʵĴ�С��v(��)______(�����������������)v(��)��
��ƽ��ʱn(CH3OCH3)��________��ƽ��ʱCO��ת���ʣ�________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com