
【题目】二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)利用水煤气合成二甲醚的总反应为:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g);ΔH=-246.4 kJ·mol-1 它可以分为两步,反应分别如下:
CH3OCH3(g)+CO2(g);ΔH=-246.4 kJ·mol-1 它可以分为两步,反应分别如下:
①4H2(g)+2CO(g)===CH3OCH3(g)+H2O(g), ΔH1=-205.1 kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g);ΔH2=________。
(2)在一定条件下的密闭容器中,该总反应达到平衡,只改变一个条件能同时提高反应速率和CO转化率的是________(填字母代号)。
A.降低温度 B.加入催化剂
C.缩小容器体积 D.增加H2的浓度
E.增加CO的浓度
(3)在一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,在一定温度和压强下发生反应:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。
CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。
问:①反应开始时正、逆反应速率的大小:v(正)______(填“>”、“<”或“=”)v(逆)。
②平衡时n(CH3OCH3)=________,平衡时CO的转化率=________。
【答案】-41.3KJ/mol CD > 1.75 75%
【解析】
根据题意可知,本题考查焓变的计算、转化率大小和计算及反应速率的大小比较,运用盖斯定律,勒夏特列原理分析。
(1)③3H2(g)+3CO(g)CH3OCH3(g)+CO2(g)ΔH=-246.4 kJ·mol-1;①4H2(g)+2CO(g)===CH3OCH3(g)+H2O(g)ΔH1=-205.1 kJ·mol-1;②CO(g)+H2O(g)===CO2(g)+H2(g)ΔH2;由盖斯定律:①+②=③可得:ΔH=ΔH1+ΔH2=-205.1kJ·mol-1+ΔH2=-246.4 kJ·mol-1,解得ΔH2=-41.3 kJ·mol-1;
故答案为:-41.3 kJ·mol-1;
(2)A.正反应为放热反应,降低温度,平衡向正反应方向移动,CO的转化率增大,但反应速率减小,故A错误;
B.加入催化剂,反应速率增大,不影响平衡移动,CO的转化率不变,故B错误;
C.正反应为气体体积减小的反应,缩小容器体积,压强增大,反应速率增大,平衡向正反应方向移动,CO的转化率增大,故C正确;
D.增加H2的浓度,反应速率增大,平衡向正反应移动,CO的转化率增大,故D正确;
E.增加CO的浓度,反应速率增大,平衡向正反应移动,但CO的转化率减小,故E错误;
故答案为:CD;
(3)①同温同压下,气体密度之比等于平均相对分子质量之比,平衡时混合气体密度增大,说明混合气体物质的量减小,反应正向进行建立平衡,故v(正)>v(逆);
故答案为:>;
②平衡时混合气体密度是同温同压下起始时的1.6倍,则平衡时混合气体物质的量为(3mol+3mol+1mol+1mol)×![]() =5mol,则:
=5mol,则:
故平衡时n(CH3OCH3)=1.75mol,平衡时CO的转化率为为![]() ;
;
故答案为:1.75mol;75%。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】电动汽车常用电池为钴酸锂电池,工作时原理如图,N极材料是金属锂和碳的复合材料,电解质为一种能传导Li+的固体电解质,电池反应式:
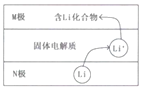
LixC6+Li1-xCoO2![]() C6+LiCoO2.下列说法错误的是( )
C6+LiCoO2.下列说法错误的是( )
A.放电时电子从N极流向M极
B.放电时N电极的反应式为:LixC6-xe-=xLi++C6
C.M极的物质具有较强还原性
D.相对于传统铅蓄电池,锂电池的比能量较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两个实验小组利用![]() 酸性溶液与
酸性溶液与![]() 溶液反应研究影响反应速率的因素。
溶液反应研究影响反应速率的因素。
设计实验方案如下![]() 实验中所用
实验中所用![]() 溶液均已加入
溶液均已加入![]() :
:
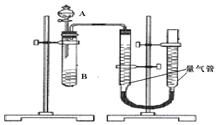
甲组:通过测定单位时间内生成![]() 气体体积的大小来比较化学反应速率的大小某同学进行实验,实验装置如图.其中A、B的成分见表
气体体积的大小来比较化学反应速率的大小某同学进行实验,实验装置如图.其中A、B的成分见表
序号 | A溶液 | B溶液 |
① |
|
|
② |
|
|
③ |
|
|
![]() 该反应的离子方程式为 ______
该反应的离子方程式为 ______
![]() 实验开始前需要检查气密性.分液漏斗中A溶液应该 ______ 加入
实验开始前需要检查气密性.分液漏斗中A溶液应该 ______ 加入![]() 填“一次性”或“逐滴滴加”
填“一次性”或“逐滴滴加”![]()
![]() 完成该实验还需要 ______
完成该实验还需要 ______ ![]() 填仪器名称
填仪器名称![]() ,实验结束后读数前需要移动量气管,使两个量气管的液面相平.
,实验结束后读数前需要移动量气管,使两个量气管的液面相平.
乙组:通过测定![]() 溶液褪色所需时间的多少来比较化学反应速率为了探究
溶液褪色所需时间的多少来比较化学反应速率为了探究![]() 与
与![]() 浓度对反应速率的影响,某同学在室温下完成以下实验
浓度对反应速率的影响,某同学在室温下完成以下实验
实验编号 | 1 | 2 | 3 | 4 |
水 | 10 | 5 | 0 | X |
| 5 | 10 | 10 | 5 |
| 5 | 5 | 10 | 10 |
时间 | 40 | 20 | 10 | --- |
![]() ______ ,4号实验中始终没有观察到溶液褪色,你认为可能的原因是 ______ 。
______ ,4号实验中始终没有观察到溶液褪色,你认为可能的原因是 ______ 。
![]() 号反应中,
号反应中,![]() 的反应速率为 ______。
的反应速率为 ______。
![]() 在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
时间 | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
温度℃ | 25 | 26 | 26 | 26 |
| 27 | 27 |
结合实验目的与表中数据,你得出的结论是 ______。
![]() 从影响化学反应速率的因素看,你的猜想还可能是 ______ 的影响。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是 ______
从影响化学反应速率的因素看,你的猜想还可能是 ______ 的影响。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是 ______ ![]() 填字母
填字母![]() 。
。
A 硫酸钾![]() 水
水![]() 二氧化锰
二氧化锰![]() 硫酸锰。
硫酸锰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M(结构式如下图)是最常用的还原剂,由H·C· Brown和 Schlesinger于1942年在芝加哥大学发现,其中X、Y、Z是原子序数依次减小的不同短周期主族元素,X与W、Z与W均能形成原子个数比为1:1和2:1的化合物,W原子的最外层电子数是电子层数的3倍,下列叙述正确的是( )
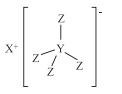
A.Y的最高价氧化物对应的水化物是一种一元弱酸
B.Z元素位于第3周期第ⅦA族
C.X和Z形成的化合物的水溶液呈酸性
D.化合物M不能与Z2W2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,7.8g乙炔和苯的混合物中含C—H键数目为0.6NA
B.10g46%的乙醇溶液中,含H—O键的数目为0.1NA
C.1L0.1mol·L1 FeCl3溶液中含Fe3+数目为0.1NA
D.将1molNH3通入足量水中,NH3 ·H2O、NH4+ 粒子数目之和为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)写出下列物质在水中电离方程式:
NaHSO4_____________________________NH3·H2O______________________________________________________
(2)写出下列物质水解的离子方程式:
NaHCO3___________________________ FeCl3_____________________________
(3)常温时,0.1mol/L的NaOH和0.06mol/L 的H2SO4溶液等体积混合,求混合溶液的pH为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25° C时,0.100 mol· L-1盐酸滴定25. 00 mL0. 1000 mol . L-1'氨水的滴定曲线如图所示。下列说法正确的是

A.滴定时,可迄用甲基橙或酚酞为指示剂
B.a、b两点水电离出的OH-浓度之比为10-4. 12
C.c点溶液中离子浓度大小顺序为c(Cl-) >c(NH4+)>c(H+ ) >c(OH-)
D.中和等体积等pH的氨水和NaOH溶液时消耗相同浓度盐酸的体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,4.48L 空气中所含原子数为0.2NA
B.常温常压下,2.3g NO2和N2O4的混合物中含有的氧原子数为0.2NA
C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2 NA
D.常温下,0.1 mol·L-1Na2CO3溶液中阴离子总数大于0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂一空气电池具有能量密度高的优点,有望成为新能源汽车的电源,其结构如图所示,其中固体电解质只允许![]() 通过。
通过。
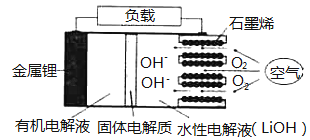
下列说法正确的是 ( )
A.放电时,负极反应式:![]()
B.放电时,当外电路中有![]() 转移时,水性电解液离子总数增加
转移时,水性电解液离子总数增加![]()
C.应用该电池电镀铜,阴极质量增加64g,理沦上将消耗![]()
D.若把水性电解液换成固体氧化物电解质,则易引起正极材料碳孔堵塞
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com