
【题目】按要求填空
(1)写出下列物质在水中电离方程式:
NaHSO4_____________________________NH3·H2O______________________________________________________
(2)写出下列物质水解的离子方程式:
NaHCO3___________________________ FeCl3_____________________________
(3)常温时,0.1mol/L的NaOH和0.06mol/L 的H2SO4溶液等体积混合,求混合溶液的pH为_______。
【答案】NaHSO4=Na++H++SO42- NH3·H2O![]() NH4++OH- HCO3-+H2O
NH4++OH- HCO3-+H2O![]() H2CO3+OH- Fe3++3H2O
H2CO3+OH- Fe3++3H2O![]() Fe(OH)3+3H+ 2
Fe(OH)3+3H+ 2
【解析】
根据题意可知,本题考查电离方程式、水解的离子方程式的书写和pH的计算,运用电离原理、水解原理和pH=-lgc(H+)分析。
(1)NaHSO4属于强电解质,在水中完全电离,因此其电离方程式为:NaHSO4=Na++H++SO42-; NH3·H2O属于弱电解质,在水中部分电离,因此其电离方程式为:NH3·H2O ![]() NH4++H+;
NH4++H+;
故答案为:NaHSO4=Na++H++SO42-;NH3·H2O ![]() NH4++OH-;
NH4++OH-;
(2)NaHCO3属于强碱弱酸盐,弱酸阴离子在水中发生水解,HCO3-+H2O![]() H2CO3+OH-;FeCl3属于强酸弱碱盐,弱碱阳离子在水中发生水解,Fe3++3H2O
H2CO3+OH-;FeCl3属于强酸弱碱盐,弱碱阳离子在水中发生水解,Fe3++3H2O![]() Fe(OH)3+3H+;
Fe(OH)3+3H+;
故答案为:HCO3-+H2O![]() H2CO3+OH-;Fe3++3H2O
H2CO3+OH-;Fe3++3H2O![]() Fe(OH)3+3H+;
Fe(OH)3+3H+;
(3)常温时,0.1mol/L的NaOH和0.06mol/L 的H2SO4溶液等体积混合,硫酸过量,设两者的体积都为VL,则剩余的![]() ,pH=-lgc(H+)=-lg0.01=2;
,pH=-lgc(H+)=-lg0.01=2;
故答案为:2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】反应N2O4(g)NO2(g)△H=+57kJmol﹣1,在温度为T时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的为( )

A.A、C两点的反应速率:v(A)>v(C)
B.A、C两点气体的颜色:A深,C浅
C.B点正逆反应速率:v(正)>v(逆)
D.A、C两点气休的平均相对分子质量:A>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俗名为“臭碱”的硫化钠广泛应用于冶金染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。设NA为阿伏加德罗常数的数值,下列说法正确的是( )
Na2S+2CO2↑。设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 0.1 mol·L-1的Na2SO4溶液中含SO42-的数目为0.1NA
B. 1 mol 13C原子所含中子数为6NA
C. 78 g Na2S中所含离子总数为2NA
D. 标准状况下,2.24 L CO2所含氧原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)是印染工业的一种常用原料,又称保险粉,是一种白色粉末,易溶于水,但不溶于乙醇,在碱性介质中稳定。
(1)Na2S2O4中S元素的化合价为____。
(2)连二亚硫酸钠在潮湿空气中极不稳定,易分解并引起燃烧,甚至发生爆炸,反应的化学方程式为:2Na2S2O4=Na2S2O3+Na2SO3+___。保存“保险粉”时常加入少量Na2CO3固体,目的是___。
(3)Na2S2O4暴露于空气中易吸收氧气和水蒸气而变质,当氧化剂和还原剂的物质的量之比为1:2时,反应产物的化学式为____。
(4)工业上可用如图装置电解NaHSO3和NaC1溶液制Na2S2O4。总反应为:2NaHSO3+2NaC1![]() Na2S2O4+2NaOH+C12↑
Na2S2O4+2NaOH+C12↑

①惰性电极a连接电源的____(填“正极”或“负极”),其电极反应式为____;
②若不加隔膜,则连二亚硫酸钠产率降低,其原因是____。
向银离子的乙二胺四乙酸(EDTA)配合物溶液中,滴加用NaOH碱化的连二亚硫酸钠溶液可生成纳米级银粉,该方法能用来测定Na2S2O4纯度,其反应原理可简单表示为:2Ag++S2O42-+4OH-=2Ag↓+2SO32-+2H2O。现取5.000g粗产品用上述方法测定纯度,将制得纳米级银过滤、洗涤、干燥、称量,其质量为4.320g。计算粗产品中连二亚硫酸钠的质量分数为____。测得连二亚硫酸钠的纯度比实际值小,若排除实验过程中的操作误差,分析可能的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)利用水煤气合成二甲醚的总反应为:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g);ΔH=-246.4 kJ·mol-1 它可以分为两步,反应分别如下:
CH3OCH3(g)+CO2(g);ΔH=-246.4 kJ·mol-1 它可以分为两步,反应分别如下:
①4H2(g)+2CO(g)===CH3OCH3(g)+H2O(g), ΔH1=-205.1 kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g);ΔH2=________。
(2)在一定条件下的密闭容器中,该总反应达到平衡,只改变一个条件能同时提高反应速率和CO转化率的是________(填字母代号)。
A.降低温度 B.加入催化剂
C.缩小容器体积 D.增加H2的浓度
E.增加CO的浓度
(3)在一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,在一定温度和压强下发生反应:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。
CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。
问:①反应开始时正、逆反应速率的大小:v(正)______(填“>”、“<”或“=”)v(逆)。
②平衡时n(CH3OCH3)=________,平衡时CO的转化率=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用图示实验装置可完成多种实验,其中不能达到相应实验目的的是

选项 | 试剂1、试剂2 | 实验目的 |
A | 过量锌粒、食醋溶液 | 测定食醋中醋酸浓度 |
B | 粗锌、过量稀硫酸 | 测定粗锌(含有不参与反应的杂质)纯度 |
C | 碳酸钠固体、水 | 证明碳酸钠水解吸热 |
D | 过氧化钠固体、水 | 证明过氧化钠与水反应产生气体 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是

A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢分解制取氢气和硫黄的反应原理为2H2S(g)![]() S2(g)+2H2(g),在2.0 L恒容密闭容器中充入0.1 mol H2S,不同温度下测得H2S的转化率与时间的关系如图所示。下列说法不正确的是
S2(g)+2H2(g),在2.0 L恒容密闭容器中充入0.1 mol H2S,不同温度下测得H2S的转化率与时间的关系如图所示。下列说法不正确的是
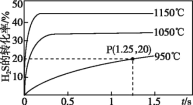
A.正反应为吸热反应
B.图中P点:v正>v逆
C.950 ℃时,0~1.25 s生成H2的平均反应速率为0.008 mol·L-1·s-1
D.950 ℃时,该反应的平衡常数的值小于3.125×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环保、安全的铝—空气电池的工作原理如下图所示,下列有关叙述错误的是
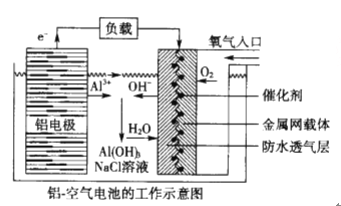
A. NaCl的作用是增强溶液的导电性
B. 正极的电极反应式为: O2+4e-+2H2O=4OH-
C. 电池工作过程中,电解质溶液的pH不断增大
D. 用该电池做电源电解KI溶液制取1molKIO3,消耗铝电极的质量为54g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com