
【题目】硫化氢分解制取氢气和硫黄的反应原理为2H2S(g)![]() S2(g)+2H2(g),在2.0 L恒容密闭容器中充入0.1 mol H2S,不同温度下测得H2S的转化率与时间的关系如图所示。下列说法不正确的是
S2(g)+2H2(g),在2.0 L恒容密闭容器中充入0.1 mol H2S,不同温度下测得H2S的转化率与时间的关系如图所示。下列说法不正确的是
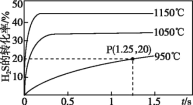
A.正反应为吸热反应
B.图中P点:v正>v逆
C.950 ℃时,0~1.25 s生成H2的平均反应速率为0.008 mol·L-1·s-1
D.950 ℃时,该反应的平衡常数的值小于3.125×10-4
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】(1)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8kJ·mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47.2kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.5kJ·mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:___。
(2)微型纽扣电池在现代生活中应用广泛。有一种银锌电池,其电极材料分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应是Zn+Ag2O=ZnO+2Ag。请回答下列问题。
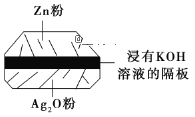
①该电池属于___电池(填“一次”或“二次”)。
②负极材料是___,电极反应式是___。
③使用时,正极区的pH__(填“增大”“减小”或“不变”,下同),电解质溶液的pH___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)写出下列物质在水中电离方程式:
NaHSO4_____________________________NH3·H2O______________________________________________________
(2)写出下列物质水解的离子方程式:
NaHCO3___________________________ FeCl3_____________________________
(3)常温时,0.1mol/L的NaOH和0.06mol/L 的H2SO4溶液等体积混合,求混合溶液的pH为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于金属腐蚀的叙述中,正确的是( )
A.金属被腐蚀的本质是M+nH2O=M(OH)n+![]() H2↑
H2↑
B.马口铁(镀锡铁)镀层破损后被腐蚀时,首先是镀层被氧化
C.金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀
D.常温下,置于空气中的金属主要发生化学腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,4.48L 空气中所含原子数为0.2NA
B.常温常压下,2.3g NO2和N2O4的混合物中含有的氧原子数为0.2NA
C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2 NA
D.常温下,0.1 mol·L-1Na2CO3溶液中阴离子总数大于0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林是日常生活中应用广泛的医药之一。它可由下列方法合成:
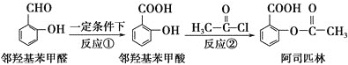
下列说法正确的是( )
A.与邻羟基苯甲酸互为同分异构体,苯环上一氯代物仅有2种且能发生银镜反应的酚类化合物共有4种
B.邻羟基苯甲醛分子中所有的原子不可能在同一平面
C.用酸性KMnO4溶液直接氧化邻羟基苯甲醛可实现反应①
D.反应②中加入适量的NaHCO3可提高阿司匹林的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:①CO燃烧热为283.0kJ·mol-l,②N2(g)+O2(g) =2NO(g) △H=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应,能消除污染,写出该反应的热化学方程式______________。
(2)某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应:
)在刚性容器内发生反应:![]() (g)+ I2(g)
(g)+ I2(g)![]()
![]() (g)+2HI(g) ΔH=+89.3 kJ·mol 1,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为____,该反应的平衡常数Kp=____Pa(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有____(填标号)。
(g)+2HI(g) ΔH=+89.3 kJ·mol 1,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为____,该反应的平衡常数Kp=____Pa(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有____(填标号)。
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
(3)室温下,烟气中的SO2可用某浓度的NaOH溶液吸收得到pH=7的溶液,试计算所得溶液中![]() =_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
=_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
(4)烟气中的SO2也可用Na2SO3溶液吸收,吸收过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 99:1 | 1:1 | 1:99 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度由小到大的顺序为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究固体甲(含两种元素)和固体乙(无机矿物盐,含五种元素)的组成和性质,设计并完成了如下实验:
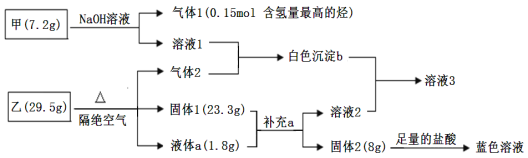
已知:向溶液1中连续滴加盐酸,先产生白色沉淀,后沉淀溶解;向溶液2中连续通入气体2,也是先产生白色沉淀,后沉淀溶解。请回答下列问题:
(1)甲的化学式____________,乙的化学式______________。
(2)加热条件下,气体1与固体2反应,产物中有一种气体和一种固体,该反应的化学方程式为__________________。
(3)气体2与足量溶液1反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢是用途很广的绿色氧化剂,它的水溶液俗称双氧水,常用于消毒、杀菌、漂白等。试回答下列问题:
(1)写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程式:____________。
(2)Na2O2、K2O2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。则上述最适合的过氧化物是________。
(3)甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上,实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛溶液依次加入到质量分数为30%~70%的过氧化氢溶液中,则该反应的化学方程式为________,过氧化氢比理论用量稍多,其目的是________。反应温度最好控制在30 ~70℃,温度不易过高,其主要原因是________。
(4)下图是硼氢化钠一过氧化氢燃料电池示意图。该电池工作时,正极附近溶液的pH________(填“增大”、“减小”或“不变”)。
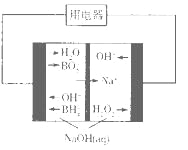
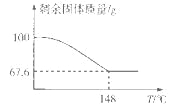
(5)Na2CO3·xH2O2可消毒、漂白。现称取100 g的Na2CO3·xH2O2晶体加热,实验结果如图所示,则该晶体的组成为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com