
【题目】(1)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8kJ·mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47.2kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.5kJ·mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:___。
(2)微型纽扣电池在现代生活中应用广泛。有一种银锌电池,其电极材料分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应是Zn+Ag2O=ZnO+2Ag。请回答下列问题。
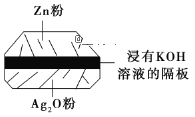
①该电池属于___电池(填“一次”或“二次”)。
②负极材料是___,电极反应式是___。
③使用时,正极区的pH__(填“增大”“减小”或“不变”,下同),电解质溶液的pH___。
【答案】CO(g)+FeO(s)=Fe(s)+CO2(g) ΔH=-218.0kJ·mol-1 一次 Zn Zn+2OH--2e-=ZnO+H2O 增大 不变
【解析】
(1)根据盖斯进行分析计算;
(2)银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应是Zn+Ag2O═ZnO+2Ag,该原电池中,Zn元素化合价由0价变为+2价、Ag元素化合价由+1价变为0价,所以Zn是负极失电子发生氧化反应,Ag2O是正极得电子发生还原反应;负极电极反应式为:Zn+2OH--2e-=ZnO+H2O、正极电极反应式为:Ag2O+H2O+2e-=2Ag+2OH-,据此回答。
(1)由①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol
结合盖斯定律可知,(①×3-②-③×2)×![]() 得到CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol,
得到CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol,
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol;
(2)①银锌电池属于一次电池,故答案为:一次;
②该原电池中,Zn元素化合价由0价变为+2价、Ag元素化合价由+1价变为0价,所以Zn是负极失电子发生氧化反应,负极电极反应式为:Zn+2OH--2e-=ZnO+H2O,故答案为:Zn;Zn+2OH--2e-=ZnO+H2O;
③正极电极反应式为:Ag2O+H2O+2e-=2Ag+2OH-生成氢氧根离子,所以pH增大,总反应是Zn+Ag2O═ZnO+2Ag,电解质溶液的pH不变,故答案为:增大;不变。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】化学学习小组模拟侯德榜制碱法制取Na2CO3的过程如下:

已知:①反应Ⅰ的化学方程式为:NH3+H2O+CO2=NH4HCO3
②滤液含NH4Cl等溶质
⑴反应Ⅱ为复分解反应,写出该反应的化学方程式______。
⑵验证滤液中含Cl-离子的实验方法和现象为______。
⑶反应Ⅲ的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)NO2(g)△H=+57kJmol﹣1,在温度为T时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的为( )

A.A、C两点的反应速率:v(A)>v(C)
B.A、C两点气体的颜色:A深,C浅
C.B点正逆反应速率:v(正)>v(逆)
D.A、C两点气休的平均相对分子质量:A>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明![]() 溶液中存在水解平衡SO32-+H2OHSO3-+OH-的事实是
溶液中存在水解平衡SO32-+H2OHSO3-+OH-的事实是
A.滴入酚酞溶液变红,再加入![]() 溶液红色褪去
溶液红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,在加入![]() 溶液后产生沉淀且红色褪去
溶液后产生沉淀且红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工业生产和国防建设中有广泛应用。回答下列问题:
(1)氮气性质稳定,可用作保护气。请用电子式表示氮气的形成过程:
。
(2)联氨(N2H4)是一种还原剂。已知:H2O(l)=H2O(g) △H=+44kJ/mol。试结合下表数据,写出N2H4 (g)燃烧热的热化学方程式: 。
化学键 | N—H | N—N | N=N | N≡N | O=O | O—H |
键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(3)KCN可用于溶解难溶金属卤化物。将AgI溶于KCN溶液中,形成稳定的Ag(CN)2—,该转化的离子方程式为: 。若已知Ksp(AgI)=1.5×10—16,K稳[Ag(CN)2—]=1.0×10-21,则上述转化方程式的平衡常数K= 。(提示:K稳越大,表示该化合物越稳定)
(4)氨的催化氧化用于工业生产硝酸。该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式: 。
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2![]()
![]() N2O4其相关图像如下。
N2O4其相关图像如下。
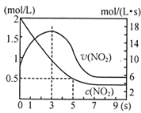
①0~3s时v(NO2)增大的原因是 。
②5s时NO2转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组以重铬酸钾(K2Cr2O7)溶液为研究对象,结合所学反应原理的知识改变条件使其发生“色彩变幻”。
已知:①K2Cr2O7溶液存在平衡:Cr2O![]() +H2O
+H2O![]() 2CrO
2CrO![]() +2H+。
+2H+。
②含铬元素的离子在溶液中的颜色:Cr2O![]() (橙色);CrO
(橙色);CrO![]() (黄色);Cr3+(绿色)。
(黄色);Cr3+(绿色)。

(1)i可证明反应Cr2O![]() +H2O
+H2O![]() 2CrO
2CrO![]() +2H+的正反应是__________(填“吸热”或“放热”)。
+2H+的正反应是__________(填“吸热”或“放热”)。
(2)ii是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是_________。
(3)iii的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验是否能达到预期目的________(填“能”或“不能”),理由是____________。
(4)根据实验Ⅱ中不同现象,可以得出的结论是__________。
(5)继续实验

①解释溶液变黄的主要原因是________。
②溶液变绿色,该反应的离子方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俗名为“臭碱”的硫化钠广泛应用于冶金染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。设NA为阿伏加德罗常数的数值,下列说法正确的是( )
Na2S+2CO2↑。设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 0.1 mol·L-1的Na2SO4溶液中含SO42-的数目为0.1NA
B. 1 mol 13C原子所含中子数为6NA
C. 78 g Na2S中所含离子总数为2NA
D. 标准状况下,2.24 L CO2所含氧原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)是印染工业的一种常用原料,又称保险粉,是一种白色粉末,易溶于水,但不溶于乙醇,在碱性介质中稳定。
(1)Na2S2O4中S元素的化合价为____。
(2)连二亚硫酸钠在潮湿空气中极不稳定,易分解并引起燃烧,甚至发生爆炸,反应的化学方程式为:2Na2S2O4=Na2S2O3+Na2SO3+___。保存“保险粉”时常加入少量Na2CO3固体,目的是___。
(3)Na2S2O4暴露于空气中易吸收氧气和水蒸气而变质,当氧化剂和还原剂的物质的量之比为1:2时,反应产物的化学式为____。
(4)工业上可用如图装置电解NaHSO3和NaC1溶液制Na2S2O4。总反应为:2NaHSO3+2NaC1![]() Na2S2O4+2NaOH+C12↑
Na2S2O4+2NaOH+C12↑

①惰性电极a连接电源的____(填“正极”或“负极”),其电极反应式为____;
②若不加隔膜,则连二亚硫酸钠产率降低,其原因是____。
向银离子的乙二胺四乙酸(EDTA)配合物溶液中,滴加用NaOH碱化的连二亚硫酸钠溶液可生成纳米级银粉,该方法能用来测定Na2S2O4纯度,其反应原理可简单表示为:2Ag++S2O42-+4OH-=2Ag↓+2SO32-+2H2O。现取5.000g粗产品用上述方法测定纯度,将制得纳米级银过滤、洗涤、干燥、称量,其质量为4.320g。计算粗产品中连二亚硫酸钠的质量分数为____。测得连二亚硫酸钠的纯度比实际值小,若排除实验过程中的操作误差,分析可能的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢分解制取氢气和硫黄的反应原理为2H2S(g)![]() S2(g)+2H2(g),在2.0 L恒容密闭容器中充入0.1 mol H2S,不同温度下测得H2S的转化率与时间的关系如图所示。下列说法不正确的是
S2(g)+2H2(g),在2.0 L恒容密闭容器中充入0.1 mol H2S,不同温度下测得H2S的转化率与时间的关系如图所示。下列说法不正确的是
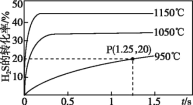
A.正反应为吸热反应
B.图中P点:v正>v逆
C.950 ℃时,0~1.25 s生成H2的平均反应速率为0.008 mol·L-1·s-1
D.950 ℃时,该反应的平衡常数的值小于3.125×10-4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com