
【题目】化学学习小组模拟侯德榜制碱法制取Na2CO3的过程如下:

已知:①反应Ⅰ的化学方程式为:NH3+H2O+CO2=NH4HCO3
②滤液含NH4Cl等溶质
⑴反应Ⅱ为复分解反应,写出该反应的化学方程式______。
⑵验证滤液中含Cl-离子的实验方法和现象为______。
⑶反应Ⅲ的化学方程式为______。
【答案】NH4HCO3+CO2=NaHCO3↓+NH4Cl 用试管取滤液少许,加稀硝酸酸化,滴加AgNO3溶液,若有白色沉淀生成,则滤液中含Cl-离子 2NaHCO3![]() NaHCO3+CO2↑+H2O
NaHCO3+CO2↑+H2O
【解析】
NaCl、CO2、NH3、H2O发生反应生成NaHCO3和NH4Cl;受热条件下,碳酸氢钠分解生成碳酸钠、二氧化碳和水;Cl-的检验常用硝酸酸化的硝酸银溶液,生成不溶于稀硝酸的AgCl沉淀。
(1)CO2、NH3和H2O反应生成NH4HCO3,因为NaHCO3溶解度较小,所以NaCl和NH4HCO3反应生成NaHCO3和NH4Cl,即NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl,故答案为:NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl;
(2)Cl-的检验常用硝酸酸化的硝酸银溶液,方法为:用试管取滤液少许,加稀硝酸酸化,滴加AgNO3溶液,若有白色沉淀生成,则滤液中含Cl-离子;故答案为:用试管取滤液少许,加稀硝酸酸化,滴加AgNO3溶液,若有白色沉淀生成,则滤液中含Cl-离子;
(3)NaHCO3对热不稳定,受热易分解生成Na2CO3、H2O、CO2,化学方程式为2NaHCO3![]() NaHCO3+CO2↑+H2O,故答案为:2NaHCO3
NaHCO3+CO2↑+H2O,故答案为:2NaHCO3![]() NaHCO3+CO2↑+H2O。
NaHCO3+CO2↑+H2O。


科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯,反应装置如图。下列对该实验的叙述错误的是
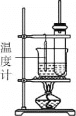
A.长玻璃管起冷凝回流作用
B.水浴加热其优点是受热均匀,便于控制温度
C.粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤
D.洗涤后,用无水CaCl2干燥,然后过滤,得到纯硝基苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
C.向氯水中加CaCO3后,溶液漂白性增强
D.在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是常见的大气污染物,燃煤是产生SO2的主要原因。工业上有多种方法可以减少SO2的排放。
(1)往煤中添加一些石灰石,可使燃煤过程中产生的SO2转化成硫酸钙。该反应的总化学方程式是___________________________________。
(2)可用多种溶液做燃煤烟气中SO2的吸收液。
①分别用等物质的量浓度的Na2SO3溶液和NaOH溶液做吸收液,当生成等物质的量NaHSO3时,两种吸收液体积比V(Na2SO3): V(NaOH)=_________________。
②NaOH溶液吸收了足量的SO2后会失效,可将这种失效的溶液与一定量的石灰水溶液充分反应后过滤,使NaOH溶液再生,再生过程的离子方程式是_________________。
(3)甲同学认为BaCl2溶液可以做SO2的吸收液。为此甲同学设计如下实验(夹持装置和加热装置略,气密性已检验)。反应开始后,A中Na2SO3固体表面有气泡产生同时有白雾生成;B中有白色沉淀。甲同学认为B中白色沉淀是SO2与BaCl2溶液反应生成的BaSO3,所以BaCl2溶液可做SO2吸收液。
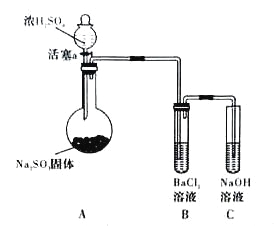
乙同学认为B中的白色沉淀是BaSO4,产生BaSO4的原因是:
①A中产生的白雾是浓硫酸的酸雾,进入B中与BaCI2溶液反应生成BaSO4沉淀。
②________________________________________________。
为证明SO2与BaCl2溶液不能得到BaSO3沉淀,乙同学对甲同学的实验装置做了如下改动并实验(夹持装置和加热装置略,气密性已检验):
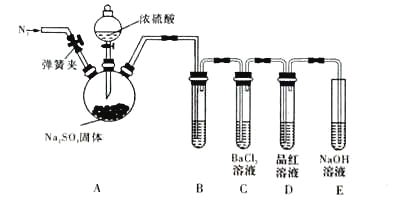
反应开始后,A中Na2SO3固体表面有气泡产生同时有白雾生成;B、C试管中除了有气泡外,未见其它现象;D中红色褪去。
③试管B中试剂是__________________溶液;滴加浓硫酸之前的操作是____________________。
④通过甲、乙两位同学的实验,得出的结论是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:

下列叙述错误的是
A. X、Y和Z均能使溴水褪色
B. X和Z均能与NaHCO3溶液反应放出CO2
C. Y既能发生取代反应,也能发生加成反应
D. Y可作加聚反应单体,X可作缩聚反应单体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示“![]() 的氧化性随溶液pH的增大逐渐减弱”。某化学小组同学用下列装置和试剂进行实验,探究
的氧化性随溶液pH的增大逐渐减弱”。某化学小组同学用下列装置和试剂进行实验,探究![]() 与KI溶液发生反应的条件。
与KI溶液发生反应的条件。

供选试剂:![]() 溶液、
溶液、![]() 固体、
固体、![]() 固体。
固体。
该小组同学设计![]() 、
、![]() 两组实验,记录如下:
两组实验,记录如下:
| 实验操作 | 实验现象 |
| 向Ⅰ试管中加入 | Ⅱ试管中有气泡冒出,溶液不变蓝 |
| 向Ⅰ试管中加入 Ⅱ试管中加入适量 | Ⅱ试管中有气泡冒出,溶液变蓝 |
(1)选择Ⅰ装置用![]() 固体制取
固体制取![]() ,为避免
,为避免![]() 固体随
固体随![]() 进入Ⅱ试管对实验造成干扰,应进行的改进是________,
进入Ⅱ试管对实验造成干扰,应进行的改进是________,![]() 组实验中
组实验中![]() 与KI溶液反应的离子方程式是________。
与KI溶液反应的离子方程式是________。
(2)对比![]() 、
、![]() 两组实验可知,
两组实验可知,![]() 与KI溶液发生反应的适宜条件是________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________。
与KI溶液发生反应的适宜条件是________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________。
(3)为进一步探究碱性条件下KI与![]() 能否反应,用上图中的装置继续进行实验:
能否反应,用上图中的装置继续进行实验:
| 实验操作 | 实验现象 |
| 向Ⅰ试管中加入 | 溶液略变蓝 |
| 向Ⅰ试管中加入 | 无明显变化 |
对于实验![]() 的现象,小明同学提出猜想“
的现象,小明同学提出猜想“![]() 时
时![]() 不能氧化
不能氧化![]() ”,设计了下列装置进行实验,验证猜想。
”,设计了下列装置进行实验,验证猜想。
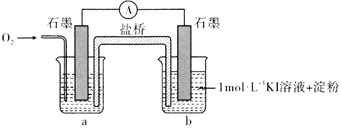
(i)烧杯a中的溶液为________。
(ii)实验结果表明,此猜想不成立。支持该结论的实验现象是通入![]() 后________。
后________。
(iii)小刚同学向![]() 的KOH溶液
的KOH溶液![]() 含淀粉
含淀粉![]() 中滴加碘水,溶液先变蓝后迅速褪色。经检测褪色后的溶液中含有
中滴加碘水,溶液先变蓝后迅速褪色。经检测褪色后的溶液中含有![]() ,褪色的原因是________
,褪色的原因是________![]() 用离子方程式表示
用离子方程式表示![]() 。
。
(4)该小组同学对实验过程进行了反思:实验![]() 的现象产生的原因可能是________。
的现象产生的原因可能是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素(![]() )是一种天然香料,常存在于黑香豆、兰花等植物中。
)是一种天然香料,常存在于黑香豆、兰花等植物中。
⑴香豆素的分子式是________,属于________(填“无机化合物”或“有机化合物”)。
⑵香豆素能使溴水褪色,因为结构中含________(填官能团名称),其与Br2发生___反应(填反应类型)。
⑶香豆素具有还原性,向酸性高锰酸钾溶液加入足量的香豆素,充分振荡,实验现象为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
I.(1)已知:一定条件下![]() 可被甲烷还原“纳米级”的金属铁。其反应为:
可被甲烷还原“纳米级”的金属铁。其反应为:
![]()
①此反应的化学平衡常数表达式为______
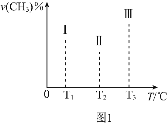
②在容积均为VL的I、II、III三个相同密闭容器中加入足量![]() ,然后分别充入amol
,然后分别充入amol![]() ,三个容器的反应温度分别为
,三个容器的反应温度分别为![]() 、
、![]() 、
、![]() 且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时
且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时![]() 的体积分数如图1所示,此时I、II、III三个容器中一定处于化学平衡状态的是______;上述反应的
的体积分数如图1所示,此时I、II、III三个容器中一定处于化学平衡状态的是______;上述反应的![]() ______
______![]() 填“大于”或“小于”
填“大于”或“小于”![]() ,该反应在______
,该反应在______![]() 填“高温”、“低温”或“任意温度”
填“高温”、“低温”或“任意温度”![]() 下可自发进行。
下可自发进行。
![]() 利用天然气为原料的一种工业合成氨简式流程图如图2:
利用天然气为原料的一种工业合成氨简式流程图如图2:
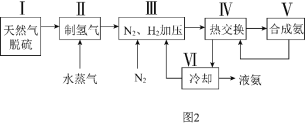
(1)步骤Ⅱ中制氢气的原理如下:Ⅰ![]() ;
;![]()
Ⅱ![]() ;
;![]()
①对于反应Ⅰ,在一定温度下的恒容容器中,表示其已达到最大化学反应限度的叙述正确的是______。
A.单位时间内1mol![]() 消耗,同时有3mol
消耗,同时有3mol![]() 生成;
生成;
B.![]() 、
、![]() 、CO的物质的量浓度相等;
、CO的物质的量浓度相等;
C.混合气体的密度不再改变;
D.混合气体的压强不再改变。
②则反应![]() ;
;![]() ______
______![]() 用含
用含![]() 、
、![]() 的代数式表示
的代数式表示![]() 。
。
(2)合成氨是人类科学技术上的一项重大突破,反应原理为:![]() 在容积为10L的密闭容器中进行,起始时充入
在容积为10L的密闭容器中进行,起始时充入![]()
![]() 、
、![]()
![]() 反应在不同条件下进行,反应体系总压强随时间的变化如图3所示。
反应在不同条件下进行,反应体系总压强随时间的变化如图3所示。
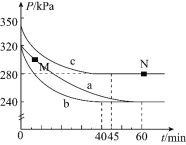
①实验a从开始至平衡时的反应速率![]() ______;实验c中
______;实验c中![]() 的平衡转化率
的平衡转化率![]() 为______。
为______。
②与实验a相比,其他两组改变的实验条件是:b______,c______。
③M点的逆反应速率![]() ______N点的正反应速率
______N点的正反应速率![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ;N点时再加入一定量
;N点时再加入一定量![]() ,平衡后
,平衡后![]() 的体积分数______
的体积分数______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8kJ·mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47.2kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.5kJ·mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:___。
(2)微型纽扣电池在现代生活中应用广泛。有一种银锌电池,其电极材料分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应是Zn+Ag2O=ZnO+2Ag。请回答下列问题。
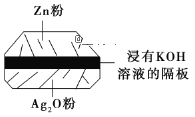
①该电池属于___电池(填“一次”或“二次”)。
②负极材料是___,电极反应式是___。
③使用时,正极区的pH__(填“增大”“减小”或“不变”,下同),电解质溶液的pH___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com