
【题目】新型锂一空气电池具有能量密度高的优点,有望成为新能源汽车的电源,其结构如图所示,其中固体电解质只允许![]() 通过。
通过。
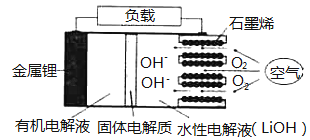
下列说法正确的是 ( )
A.放电时,负极反应式:![]()
B.放电时,当外电路中有![]() 转移时,水性电解液离子总数增加
转移时,水性电解液离子总数增加![]()
C.应用该电池电镀铜,阴极质量增加64g,理沦上将消耗![]()
D.若把水性电解液换成固体氧化物电解质,则易引起正极材料碳孔堵塞
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)利用水煤气合成二甲醚的总反应为:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g);ΔH=-246.4 kJ·mol-1 它可以分为两步,反应分别如下:
CH3OCH3(g)+CO2(g);ΔH=-246.4 kJ·mol-1 它可以分为两步,反应分别如下:
①4H2(g)+2CO(g)===CH3OCH3(g)+H2O(g), ΔH1=-205.1 kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g);ΔH2=________。
(2)在一定条件下的密闭容器中,该总反应达到平衡,只改变一个条件能同时提高反应速率和CO转化率的是________(填字母代号)。
A.降低温度 B.加入催化剂
C.缩小容器体积 D.增加H2的浓度
E.增加CO的浓度
(3)在一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,在一定温度和压强下发生反应:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。
CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。
问:①反应开始时正、逆反应速率的大小:v(正)______(填“>”、“<”或“=”)v(逆)。
②平衡时n(CH3OCH3)=________,平衡时CO的转化率=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A有如下转化关系:
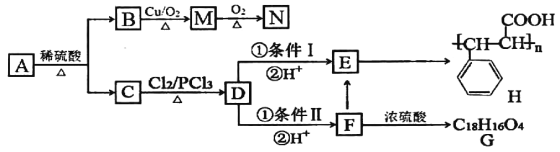
已知:①有机物B是芳香烃的含氧衍生物,其相对分子质量为108,B中氧的质量分数为14.8%。
②CH3-CH2-COOH+Cl2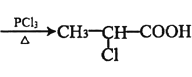 +HCl
+HCl
根据以上信息,回答下列问题:
(1)B的分子式为___________;有机物D中含氧官能团名称是_____________。
(2)A的结构简式为_________________ ;检验M中官能团的试剂是______________。
(3)条件I为_________________;D→F的反应类型为________________。
(4)写出下列转化的化学方程式:
F→E______________________________________
F→G_____________________________________。
(5)N的同系物X比N相对分子质量大14,符合下列条件的X的同分异构体有_________种(不考虑立体异构),写出其中核磁共振氢谱有五组峰,且吸收峰的面积之比为1∶1∶2∶2∶2的同分异构体的结构简式______________(写一种)。
①含有苯环; ②能发生银镜反应; ③遇FeCl3溶液显紫色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰乙酸乙酯是有机合成中非常重要的原料,实验室制备乙酰乙酸乙酯的反应原理、装置示意图和有关数据如下所示:

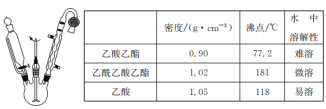
实验步骤:
Ⅰ.合成:向三颈烧瓶中加入9.8ml无水乙酸乙酯,迅速加入0.1g切细的金属钠。水浴加热反应液,缓慢回流约2h至金属钠全部反应完。停止加热,冷却后向反应混合物中加入50%乙酸至反应液呈弱酸性。
Ⅱ.分离与提纯:
①向反应混合物中加入等体积的饱和食盐水,分离得到有机层。
②水层用5mL无水乙酸乙酯萃取,分液。
③将①②所得有机层合并,洗涤、干燥、蒸馏得到乙酰乙酸乙酯粗产品。
④蒸馏粗产品得到乙酰乙酸乙酯3.9g。
(1)球形冷凝管中冷却水从______(填“上”或“下”)口进入,上方干燥管中盛无水CaCl2,其作用是________。
(2)实验室制备乙酰乙酸乙酯时,通常在无水乙酸乙酯中加入微量的无水乙醇,其作用是___。
(3)分离与提纯操作①中使用的分离仪器是________。加入饱和食盐水的作用是 _______。
(4)分离与提纯操作③用饱和NaHCO3溶液洗涤的目的是 _______。
(5)本实验的产率为_______ %(结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是( )
A.由水电离产生的c(H+)=1x10-13 mol/L的溶液中:Na+、K+、Cl-、SO42-
B.室温下,pH=1的盐酸中:Na+、Fe2+、NO3-、SO42-
C.含有Ca2+的溶液中:Na+、K+、CO32-、Cl-
D.常温下在KW/ c(OH-)=10-12的溶液中:K+、Al3+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环保、安全的铝—空气电池的工作原理如下图所示,下列有关叙述错误的是
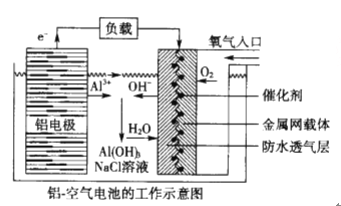
A. NaCl的作用是增强溶液的导电性
B. 正极的电极反应式为: O2+4e-+2H2O=4OH-
C. 电池工作过程中,电解质溶液的pH不断增大
D. 用该电池做电源电解KI溶液制取1molKIO3,消耗铝电极的质量为54g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应速率的说法正确的是 ( )
A. 升高温度可降低化学反应的活化能,使化学反应速率提高
B. 在温度、体积都相同的两容器中,分别充入相同物质的量的Br2和Cl2,让它们与等量的氢气发生反应,反应速率相同
C. 0.1 mol·L-1盐酸和0.1 mol·L-1硝酸与相同形状和大小的大理石反应的速率相同
D. 有气体参加的化学反应,若增大压强(即缩小反应容器的容积),可增加活化分子的百分数,从而使反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将pH和体积均相同的HCl和CH3COOH溶液分别加水稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
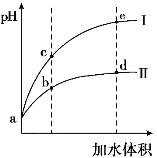
A.曲线II代表HCl的稀释过程
B.溶液中水的电离程度:b点>c点
C.从b点到d点,溶液中![]() 保持不变
保持不变
D.该温度下,b点Kw的数值比e点大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下,可逆反应aA(g)+bB(g)![]() cC(g)+dD(g)的平衡常数为K,下列说法正确的是( )
cC(g)+dD(g)的平衡常数为K,下列说法正确的是( )
A.正、逆反应的平衡常数数值相同,符号相反
B.升高温度,K值增大
C.K越大,说明该反应的进行程度越大,转化率越高
D.该反应的K=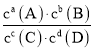
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com