
【题目】在某温度下,可逆反应aA(g)+bB(g)![]() cC(g)+dD(g)的平衡常数为K,下列说法正确的是( )
cC(g)+dD(g)的平衡常数为K,下列说法正确的是( )
A.正、逆反应的平衡常数数值相同,符号相反
B.升高温度,K值增大
C.K越大,说明该反应的进行程度越大,转化率越高
D.该反应的K=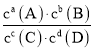
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】新型锂一空气电池具有能量密度高的优点,有望成为新能源汽车的电源,其结构如图所示,其中固体电解质只允许![]() 通过。
通过。
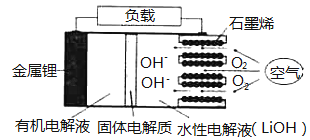
下列说法正确的是 ( )
A.放电时,负极反应式:![]()
B.放电时,当外电路中有![]() 转移时,水性电解液离子总数增加
转移时,水性电解液离子总数增加![]()
C.应用该电池电镀铜,阴极质量增加64g,理沦上将消耗![]()
D.若把水性电解液换成固体氧化物电解质,则易引起正极材料碳孔堵塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验现象得出的结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 废FeCl3蚀刻液X中加入少量铁粉,振荡 | 得到澄清溶液 | X中一定不含Cu2+ |
B | 浓度均为0.1molL-1的Na2CO3和Na2S混合溶液中,滴入少量AgNO3溶液 | 产生黑色沉淀 | Ksp(Ag2S)大于Ksp(Ag2CO3) |
C | KNO3和KOH混合溶液中加入铝粉并加热,管口放湿润的红色石蕊试纸 | 试纸变为蓝色 | NO3-还原为NH3 |
D | KBrO3溶液中加入少量苯,然后通入少量Cl2 | 有机相呈橙色 | 氧化性:Cl2>Br2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物是化工、能源、环保等领域的研究热点。回答下列问题:
(1)N2O在金粉表面发生热分解反应:2N2O(g)![]() 2N2(g)+O2(g) H
2N2(g)+O2(g) H
己知:4NH3(g)+3O2(g)=2N2(g)+6H2O(l) H1
2NH3(g)+3N2O(g)=4N2(g)+3H2O(l) H2
H=____(用含H1、H2的代数式表示)。
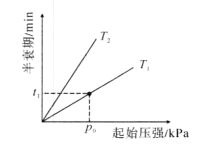
(2)一氧化二氮可反生2N2O(g)![]() 2N2(g)+O2(g)。不同温度(T),N2O分解半哀期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___T2(填“>”、“=”或“<”)。当温度为T1、起始压强为P0,反应至t1min时,体系压强P=____(用P0表示)。
2N2(g)+O2(g)。不同温度(T),N2O分解半哀期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___T2(填“>”、“=”或“<”)。当温度为T1、起始压强为P0,反应至t1min时,体系压强P=____(用P0表示)。
(3)将NH3与O2按体积比4:5充入刚性容器中,起始体系总压强为P0kPa,分别在催化剂M、N作用下发生反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g) H3=-905.0kJ/mol,NH3的分压(P)与时间和温度的关系如图所示:
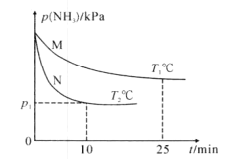
①催化剂的催化效果:M____N(填“强于”或“弱于”)。
②T°C时,0~12.5min内P(NH3)减小量___(填“>”、“=”或“<”)12.5~25min内P(NH3)减小量,理由为___。
(4)NaClO2是一种绿色消毒剂和漂白剂,工业上采用电解法制备NaClO2的原理如图所示。
①交换膜应选用___(填“阳离子交换膜”或“阴离子交换膜”)。
②阳极的电极反应式为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。现给出化学键的键能(见下表):

计算H2(g)+ Br2(g)===2HBr(g)的反应热 ( )
A. +103 kJ·mol-1 B. +679 kJ·mol-1
C. -103 kJ·mol-1 D. +183 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
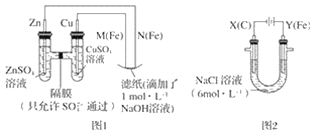
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。
请回答:
Ⅰ.用图 1 所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是__(填字母序号)。
A 铝 B 石墨 C 银 D 铂
(2)N 极发生反应的电极反应式为__。
Ⅱ.用图 2 所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。 查阅资料得知,高铁酸根离子(FeO42-)在溶液中呈紫红色。
(3)电解过程中,X 极区溶液的 pH__(填“增大”“减小”或“不变”)。
(4)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣= FeO42-+4H2O 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少____g。
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Z=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧电池中的Zn、Mn元素的回收,对环境保护有重要的意义。锌锰干电池的负极是作为电池壳体的金属锌,正极是被二氧化锰和碳粉包围的石墨电极,电解质是氯化锌和氯化铵的糊状物,该电池放电过程中产生MnOOH。
I.回收锌元素,制备ZnCl2
步骤一:向除去壳体及石墨电极的黑色糊状物中加水,搅拌,充分溶解,经过滤分离得固体和滤液;
步骤二:处理滤液,得到ZnCl2·xH2O晶体;
步骤三:将SOCl2与ZnCl2·xH2O晶体混合制取无水ZnCl2。
制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略)的装置如下:
已知:SOCl2是一种常用的脱水剂,熔点-105℃,沸点79℃,140℃以上时易分解,与水剧烈水解生成两种气体。
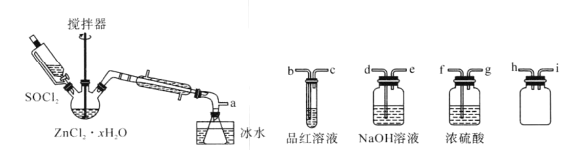
(1)接口的连接顺序为a→___→____→h→i→___→___→___→e。
(2)三颈烧瓶中反应的化学方程式:____。
(3)步骤二中得到ZnCl2·xH2O晶体的操作方法:___。
(4)验证生成物中含有SO2的现象为:___。
II.回收锰元素,制备MnO2
(5)步骤一得到的固体经洗涤,初步蒸干后进行灼烧,灼烧的目的____。
III.二氧化锰纯度的测定
称取1.0g灼烧后的产品,加入1.34g草酸钠(Na2C2O4)固体,再加入足量的稀硫酸并加热(杂质不参与反应),充分反应后冷却,将所得溶液转移到100mL容量瓶中用蒸馏水稀释至刻度线,从中取出10.00mL,用0.0200mol/L高锰酸钾溶液进行滴定,滴定三次,消耗高锰酸钾溶液体积的平均值为10.00mL。
(6)写出MnO2溶解反应的离子方程式___。
(7)产品的纯度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组设计用含氯的有机物A合成棉织物免烫抗皱整理剂M的路线如下(部分反应试剂和条件未注明):

已知:①E的分子式为C5H8O4,能发生水解反应,核磁共振氢谱显示E分子内有2种不同化学环境的氢原子,其个数比为3∶1;

(R、R′、R″代表相同或不相同的烃基)。
(1)A分子中的含氧官能团的名称是________________。
(2)D→E反应的化学方程式是____________。
(3)A→B反应所需的试剂是________________。
(4)G→H反应的化学方程式是____________。
(5)已知1 mol E与2 mol J反应生成1 mol M,则M的结构简式是________。
(6)E的同分异构体有下列性质:①能与NaHCO3反应生成CO2;②能发生水解反应,且水解产物之一能发生银镜反应,则该同分异构体共有________种,其中任意1种的结构简式是________。
(7)J可合成高分子化合物,该高分子化合物的结构简式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物在现代生产和生活中发挥重要作用。
(1)可以通过热化学循环在较低温度下由硫化氢分解制备氢气。
SO2(g)+I2(s)+2H2O(1)==2HI(aq)+H2SO4(aq) △H1=—151.5kJ·mol-1
2HI(aq)==H2(g)+I2(s) △H2=+110kJ·mol-1
H2S(g)+H2SO4(aq)==S(s)+SO2(g)+2H2O(I) △H3=+65kJ·mol-1
热化学硫碘循环硫化氢分解联产氢气、硫磺的热化学方程式为_________________。
(2)硫酸厂尾气中含有大量SO2,为提高其利用率可用图1所示装置(电极均为惰性电极)将其吸收,而锂—磺酰氯(Li—SO2C12)电池可作为电源电解制备Ni(H2PO2)2(图2)。已知电池反应为:2Li+SO2C12=2LiCl+SO2↑
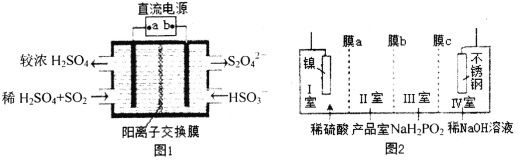
①图1中:a为直流电源的______极(填“负”或“正”),其阴极的电极反应式为_____。
②SO2C12分子中S原子的杂化方式为____________________。
③锂—磺酰氯电池的正极反应式为_______________________。
④图2中膜a为______交换膜(填“阳离子”或“阴离子”下同),膜c为_________交换膜。不锈钢电极的电极反应式为_______________________________。
(3)二氧化硫的催化氧化是工业上生产硫酸的主要反应O2(g)+2SO2(g) ![]() 2SO3(g)。
2SO3(g)。
已知:标准平衡常数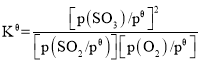 ,其中
,其中![]() 为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为
为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为![]() ,则
,则![]() _______(用含
_______(用含![]() 的最简式表示)。
的最简式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com