
【题目】含氮化合物是化工、能源、环保等领域的研究热点。回答下列问题:
(1)N2O在金粉表面发生热分解反应:2N2O(g)![]() 2N2(g)+O2(g) H
2N2(g)+O2(g) H
己知:4NH3(g)+3O2(g)=2N2(g)+6H2O(l) H1
2NH3(g)+3N2O(g)=4N2(g)+3H2O(l) H2
H=____(用含H1、H2的代数式表示)。
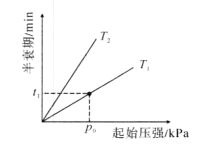
(2)一氧化二氮可反生2N2O(g)![]() 2N2(g)+O2(g)。不同温度(T),N2O分解半哀期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___T2(填“>”、“=”或“<”)。当温度为T1、起始压强为P0,反应至t1min时,体系压强P=____(用P0表示)。
2N2(g)+O2(g)。不同温度(T),N2O分解半哀期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___T2(填“>”、“=”或“<”)。当温度为T1、起始压强为P0,反应至t1min时,体系压强P=____(用P0表示)。
(3)将NH3与O2按体积比4:5充入刚性容器中,起始体系总压强为P0kPa,分别在催化剂M、N作用下发生反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g) H3=-905.0kJ/mol,NH3的分压(P)与时间和温度的关系如图所示:
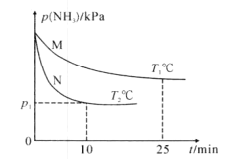
①催化剂的催化效果:M____N(填“强于”或“弱于”)。
②T°C时,0~12.5min内P(NH3)减小量___(填“>”、“=”或“<”)12.5~25min内P(NH3)减小量,理由为___。
(4)NaClO2是一种绿色消毒剂和漂白剂,工业上采用电解法制备NaClO2的原理如图所示。
①交换膜应选用___(填“阳离子交换膜”或“阴离子交换膜”)。
②阳极的电极反应式为_____。

【答案】![]() △H2-
△H2-![]() △H1 > 1.25p0 弱与 > 反应物的浓度逐渐减小,反应速率减慢 阳离子交换膜 2Cl--2e-=Cl2↑
△H1 > 1.25p0 弱与 > 反应物的浓度逐渐减小,反应速率减慢 阳离子交换膜 2Cl--2e-=Cl2↑
【解析】
(1)已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(1)△H1
②2NH3(g)+3N2O(g)=4N2(g)+3H2O(1)△H2
盖斯定律计算(②×2-①)×![]() 得到N2O在金粉表面发生热分解:2N2O(g)=2N2(g)+O2(g)△H=
得到N2O在金粉表面发生热分解:2N2O(g)=2N2(g)+O2(g)△H=![]() △H2-
△H2-![]() △H1;
△H1;
(2)温度越高,反应越快,半衰期越短,等压强p0下可以看出T2下的半衰期长因此T1大于T2;
压强之比等于物质的量之比,半衰期指的是任一浓度N2O消耗一半所需要的时间,由反应方程式可知,设起始时有2molN2O,t1时生成1mol N2和0.5mol O2,还剩1molN2O,故混合气体的总物质的量为(1+0.5+1)mol=2.5mol,因此在T1、p0下反应后的物质的量是起始的1.25倍,故p=1.25p0;
(3)①该反应焓变小于0,正反应为放热反应,温度越高平衡左移,氨气的平衡分压越高,所以T1>T2,据图可知在N催化剂的作用下温度较低的反应先达到平衡,说明M的催化效果弱与N的催化效果;
②随着反应进行,反应物的浓度逐渐减小,反应速率减慢,所以0~12.5min内P(NH3)减小量大于12.5~25min内P(NH3)减小量;
(4)①由ClO2→NaClO2可知,Cl的化合价降低,所以ClO2发生失去电子的氧化反应,即A电极为电解池的阴极,电极反应式为ClO2+e-=ClO2-,结合Na+生成NaClO2,所以钠离子由阳极区移向阴极区,则离子交换膜为阳离子交换膜;
②阳极区Cl-失去电子生成Cl2,电极反应式为2Cl--2e-=Cl2↑。


科目:高中化学 来源: 题型:
【题目】乙酰乙酸乙酯是有机合成中非常重要的原料,实验室制备乙酰乙酸乙酯的反应原理、装置示意图和有关数据如下所示:

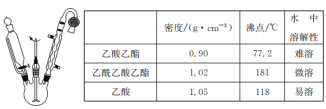
实验步骤:
Ⅰ.合成:向三颈烧瓶中加入9.8ml无水乙酸乙酯,迅速加入0.1g切细的金属钠。水浴加热反应液,缓慢回流约2h至金属钠全部反应完。停止加热,冷却后向反应混合物中加入50%乙酸至反应液呈弱酸性。
Ⅱ.分离与提纯:
①向反应混合物中加入等体积的饱和食盐水,分离得到有机层。
②水层用5mL无水乙酸乙酯萃取,分液。
③将①②所得有机层合并,洗涤、干燥、蒸馏得到乙酰乙酸乙酯粗产品。
④蒸馏粗产品得到乙酰乙酸乙酯3.9g。
(1)球形冷凝管中冷却水从______(填“上”或“下”)口进入,上方干燥管中盛无水CaCl2,其作用是________。
(2)实验室制备乙酰乙酸乙酯时,通常在无水乙酸乙酯中加入微量的无水乙醇,其作用是___。
(3)分离与提纯操作①中使用的分离仪器是________。加入饱和食盐水的作用是 _______。
(4)分离与提纯操作③用饱和NaHCO3溶液洗涤的目的是 _______。
(5)本实验的产率为_______ %(结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将pH和体积均相同的HCl和CH3COOH溶液分别加水稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
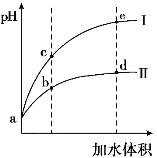
A.曲线II代表HCl的稀释过程
B.溶液中水的电离程度:b点>c点
C.从b点到d点,溶液中![]() 保持不变
保持不变
D.该温度下,b点Kw的数值比e点大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO3-===CaCO3↓+H2O
B. 酸性高锰酸钾溶液与稀草酸反应:5C2O42-+2MnO4-+16H+===2Mn2++10CO2+8H2O
C. AgCl的悬浊液中滴加Na2S溶液:2AgCl+S2-===Ag2S+2Cl-
D. NH4HCO3溶液加入过量NaOH溶液加热:NH4++OH-===NH3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2) = 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g),已知下列化学键的键能:
2NH3(g),已知下列化学键的键能:
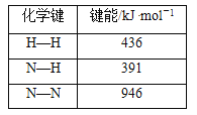
下列说法正确的是( )
A.该反应为吸热反应
B.该反应中反应物的总能量高于生成物的总能量
C.反应热ΔH=92 kJ·mol-1
D.生成1 mol NH3放出92 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下,可逆反应aA(g)+bB(g)![]() cC(g)+dD(g)的平衡常数为K,下列说法正确的是( )
cC(g)+dD(g)的平衡常数为K,下列说法正确的是( )
A.正、逆反应的平衡常数数值相同,符号相反
B.升高温度,K值增大
C.K越大,说明该反应的进行程度越大,转化率越高
D.该反应的K=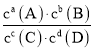
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作及现象结论描述不准确的是( )
A.向沸水中滴加饱和氯化铁溶液制备胶体,用可见光束照射,产生丁达尔效应
B.常温下,向0.10mol·L-1 NaHCO3溶液,滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出,说明加入CaCl2促进了HCO3-的水解
C.利用以下实验器材(规格数量不限):烧杯、量筒、环形玻璃搅拌棒、纸条、硬纸板、温度计能完成中和反应反应热的测定
D.向浓度均为0.1mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀,因为KSP[Mg(OH)2]>KSP[Cu(OH)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法错误的
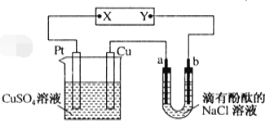
A.X极是电源正极,Y极是电源负极B.Cu电极上增重6.4g时,b极产生2.24 L气体
C.电解过程中CuSO4溶液的pH逐渐减小D.a极的电极反应式为2Cl――2e-=Cl2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com