
【题目】如图所示,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法错误的
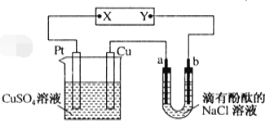
A.X极是电源正极,Y极是电源负极B.Cu电极上增重6.4g时,b极产生2.24 L气体
C.电解过程中CuSO4溶液的pH逐渐减小D.a极的电极反应式为2Cl――2e-=Cl2↑
【答案】B
【解析】
A.a、b是石墨电极,通电一段时间后,b极附近溶液显红色,依据电解质溶液为氯化钠的酚酞溶液,判断b电极是阴极生成氢气和NaOH,则Y为电源负极,X为电源正极,故A正确;
B.根据电极反应Cu-2e-=Cu2+,6.4g的铜的物质的量是0.1mol,转移电子为0.2mol,b极电极反应2H++2e-=H2↑,生成氢气为0.1mol,若为标况,则体积为2.24L,没有给温度和压强,故B错误;
C. 电解过程中CuSO4溶液中的氢氧根离子在阳极Pt电极失电子生成氧气,溶液中铜离子在Cu电极得到电子析出铜,溶液中氢离子浓度增大,溶液的pH逐渐减小,故C正确;
D.a电极是氯离子失电子发生的氧化反应,电极反应式为2Cl--2e-=Cl2↑,故D正确;
答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】含氮化合物是化工、能源、环保等领域的研究热点。回答下列问题:
(1)N2O在金粉表面发生热分解反应:2N2O(g)![]() 2N2(g)+O2(g) H
2N2(g)+O2(g) H
己知:4NH3(g)+3O2(g)=2N2(g)+6H2O(l) H1
2NH3(g)+3N2O(g)=4N2(g)+3H2O(l) H2
H=____(用含H1、H2的代数式表示)。
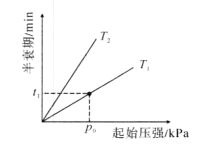
(2)一氧化二氮可反生2N2O(g)![]() 2N2(g)+O2(g)。不同温度(T),N2O分解半哀期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___T2(填“>”、“=”或“<”)。当温度为T1、起始压强为P0,反应至t1min时,体系压强P=____(用P0表示)。
2N2(g)+O2(g)。不同温度(T),N2O分解半哀期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___T2(填“>”、“=”或“<”)。当温度为T1、起始压强为P0,反应至t1min时,体系压强P=____(用P0表示)。
(3)将NH3与O2按体积比4:5充入刚性容器中,起始体系总压强为P0kPa,分别在催化剂M、N作用下发生反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g) H3=-905.0kJ/mol,NH3的分压(P)与时间和温度的关系如图所示:
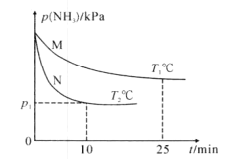
①催化剂的催化效果:M____N(填“强于”或“弱于”)。
②T°C时,0~12.5min内P(NH3)减小量___(填“>”、“=”或“<”)12.5~25min内P(NH3)减小量,理由为___。
(4)NaClO2是一种绿色消毒剂和漂白剂,工业上采用电解法制备NaClO2的原理如图所示。
①交换膜应选用___(填“阳离子交换膜”或“阴离子交换膜”)。
②阳极的电极反应式为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组设计用含氯的有机物A合成棉织物免烫抗皱整理剂M的路线如下(部分反应试剂和条件未注明):

已知:①E的分子式为C5H8O4,能发生水解反应,核磁共振氢谱显示E分子内有2种不同化学环境的氢原子,其个数比为3∶1;

(R、R′、R″代表相同或不相同的烃基)。
(1)A分子中的含氧官能团的名称是________________。
(2)D→E反应的化学方程式是____________。
(3)A→B反应所需的试剂是________________。
(4)G→H反应的化学方程式是____________。
(5)已知1 mol E与2 mol J反应生成1 mol M,则M的结构简式是________。
(6)E的同分异构体有下列性质:①能与NaHCO3反应生成CO2;②能发生水解反应,且水解产物之一能发生银镜反应,则该同分异构体共有________种,其中任意1种的结构简式是________。
(7)J可合成高分子化合物,该高分子化合物的结构简式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】杂志Joule中题为“Li—CO2 Electrochemistry:A New Strategy for CO2 Fixation and Energy Storage”的文章,阐述关于电化学技术固定CO2新的反应途径。下图是采用新能源储能器件将CO2转化为固体产物,实现CO2的固定和储能灵活应用的装置。储能器件使用的Li—CO2电池组成为钌电极/CO2—饱和LiClO4—DMSO电解液/锂片。下列说法错误的是

A.钌电极为负极,其电极反应式为:2Li2CO3+C—4e-=== 3CO2+4Li+
B.Li—CO2电池电解液由LiClO4—DMSO溶于水得到
C.这种电化学转化方式不仅减少CO2的排放,还可将CO2作为可再生能源载体
D.CO2的固定中,每生成1.5mol气体,可转移2mole-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、X、Y、Z、W为五种短周期元素,且原子序数依次增大,X、Y、Z最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g·L1;W的质子数是X、Y、Z、M四种元素质子数之和的![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.原子半径:W>Z>Y>X>M
B.常见气态氢化物的稳定性:X<Y<Z
C.1molWM溶于足量水中完全反应,共转移2mol电子
D.由M、X、Y、Z四种元素形成的化合物一定既有离子键,又有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示化学过程的化学用语书写正确的是
A.用中和热表示氢氧化钠和醋酸的稀溶液反应的热化学方程式为:H+(aq)+OH-(aq)=H2O(l) △H=57.3kJ·mol-1
B.AlCl3溶液与NaAlO2溶液混合:A13++A1O2-+3H2O![]() 2Al(OH)3↓
2Al(OH)3↓
C.HCO3-的电离:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D.Na2SO3的水解:SO32-+2H2O![]() H2SO3+2OH-
H2SO3+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物在现代生产和生活中发挥重要作用。
(1)可以通过热化学循环在较低温度下由硫化氢分解制备氢气。
SO2(g)+I2(s)+2H2O(1)==2HI(aq)+H2SO4(aq) △H1=—151.5kJ·mol-1
2HI(aq)==H2(g)+I2(s) △H2=+110kJ·mol-1
H2S(g)+H2SO4(aq)==S(s)+SO2(g)+2H2O(I) △H3=+65kJ·mol-1
热化学硫碘循环硫化氢分解联产氢气、硫磺的热化学方程式为_________________。
(2)硫酸厂尾气中含有大量SO2,为提高其利用率可用图1所示装置(电极均为惰性电极)将其吸收,而锂—磺酰氯(Li—SO2C12)电池可作为电源电解制备Ni(H2PO2)2(图2)。已知电池反应为:2Li+SO2C12=2LiCl+SO2↑
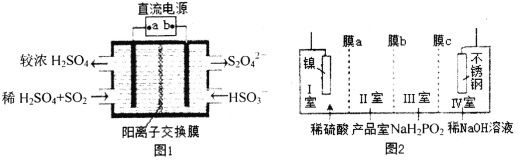
①图1中:a为直流电源的______极(填“负”或“正”),其阴极的电极反应式为_____。
②SO2C12分子中S原子的杂化方式为____________________。
③锂—磺酰氯电池的正极反应式为_______________________。
④图2中膜a为______交换膜(填“阳离子”或“阴离子”下同),膜c为_________交换膜。不锈钢电极的电极反应式为_______________________________。
(3)二氧化硫的催化氧化是工业上生产硫酸的主要反应O2(g)+2SO2(g) ![]() 2SO3(g)。
2SO3(g)。
已知:标准平衡常数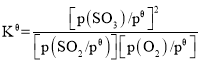 ,其中
,其中![]() 为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为
为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为![]() ,则
,则![]() _______(用含
_______(用含![]() 的最简式表示)。
的最简式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
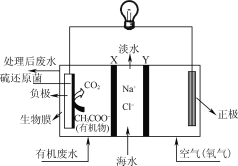
A. 该装置可以在高温下工作
B. X、Y依次为阳离子、阴离子选择性交换膜
C. 负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
D. 该装置工作时,电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.液化石油气和天然气的主要成分都是甲烷
B.乙烯和苯都能使溴水褪色,褪色的原因相同
C.用溴水可鉴别苯酚溶液、甲苯和2,4-己二烯
D.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com